Vortioxetina (▼Brintellix®, Lundbeck) en depresión
 Nº392
Nº392
Resumen
La vortioxetina es un agente antidepresivo que actúa genéricamente modulando la actividad y el transporte de la serotonina (5-HT), a través de la activación o el bloqueo de varios tipos de receptores serotonérgicos y de la inhibición del transportador de serotonina. El medicamento ha sido autorizado ficialmente para el tratamiento de episodios de depresión mayor en adultos. Se trata de un nuevo antidepresivo más a agregar al nutrido grupo de fármacos útiles para afrontar la depresión mayor, pero sin ninguna ventaja o innovación aparente sobre los actualmente disponibles.
ASPECTOS FISIOPATOLÓGICOS
La depresión es un trastorno emocional que se presenta como un estado de abatimiento e infelicidad, que puede ser transitorio o permanente; es una alteración del humor en la que destaca un ánimo deprimido, falta de energía y/o pérdida de interés, o una disminución de la capacidad para disfrutar u obtener placer (anhedonia), que afectan a la vida de la persona durante la mayor parte del día y durante al menos 2 semanas. Los síntomas se relacionan con 3 alteraciones centrales: del estado de ánimo, caracterizado por tristeza y/o irritabilidad, con una pérdida de interés en actividades que previamente agradaban al paciente (anhedonia); de la cognición, que hace que el pensamiento sea lento e ineficiente, apareciendo además un componente de gran autocrítica; y de la actividad, que disminuye, aunque puede ser ocultada por la presencia de ansiedad o agitación.
La depresión afectará a una de cada 5 mujeres y a uno de cada 10 hombres a lo largo de su vida, de manera que se calcula que sólo en España hay entre 1,2 y 1,5 millones de enfermos con depresión. Según un estudio realizado por la Escuela de Salud Pública de la Universidad de Harvard y la Organización Mundial de la Salud (OMS), la depresión será en el año 2020 el segundo mayor problema de salud del mundo, solo superado por los problemas cardiovasculares. Según el estudio ESEMeD (European Study of the Epidemiology of Mental Disorders) la prevalencia en España es inferior a la de otros países europeos, con una prevalencia-vida del episodio depresivo de 10,6% y una prevalencia- año del 4,0%, aunque una de las características más notables es que presenta una edad de inicio más temprano y altas tasas de comorbilidad y cronicidad (Gabilondo, 2010).
Por otra parte, tanto por su epidemiología como por la gravedad clínica de los cuadros depresivos, su impacto en la calidad de vida es superior al de enfermedades crónicas como la artritis, la diabetes o las enfermedades cardiacas y respiratorias. La DM es, entre las enfermedades no “fatales”, la mayor causa de años vividos con discapacidad, ocupando el cuarto lugar entre las enfermedades que provocan discapacidad. Asimismo, la depresión unipolar figura como tercera causa de carga de enfermedad, detrás de la isquemia coronaria y de los accidentes cerebrovasculares, explicando el 6% de la carga causada por todas las enfermedades. Entre el 10% y el 20% de los pacientes atendidos en las consultas de atención primaria padece un trastorno afectivo (Cuéllar, 2015).
La depresión mayor (DM) es un síndrome o agrupación de síntomas en el que predominan los síntomas afectivos (tristeza patológica, decaimiento, irritabilidad, sensación subjetiva de malestar e impotencia frente a las exigencias de la vida) aunque, en mayor o menor grado, también están presentes síntomas de tipo cognitivo, volitivo o incluso somático, por lo que podría hablarse de una afectación global de la vida psíquica, haciendo especial énfasis en la esfera afectiva. La gravedad y persistencia de estos síntomas los diferencia de cambios ordinarios en el estado de ánimo que no llegan a ser patológicos ni llegan a provocar deterioro funcional ni social, hechos característicos en la depresión.
La asociación entre trastorno depresivo y ansiedad es casi más la norma que la excepción. La comorbilidad de la depresión se observa también con el abuso del alcohol o consumo de sustancias y con algunas enfermedades orgánicas cerebrales y sistémicas. Los síndromes depresivos causados por enfermedades médicas y por medicaciones o sustancias psicoactivas no se consideran trastornos primarios del estado de ánimo y no se los atribuye el diagnóstico de trastorno depresivo mayor.
El humor depresivo y la pérdida de interés son los síntomas clave. Los pacientes comentan que se encuentran tristes, desesperanzados, inútiles y con un dolor emocional que es una agonía. Unos dos tercios de los pacientes deprimidos se plantean el suicidio y entre un 10 y un 15% llega a intentarlo; en este sentido, la tasa de mortalidad por suicidio ajustada para la edad y el sexo de las personas que padecen una depresión es 21 veces mayor que la población general (AEMPS, 2015). Casi todos los pacientes depresivos manifiestan una pérdida de energía, un empeoramiento del rendimiento escolar y laboral y una disminución de la motivación para iniciar nuevos proyectos. Un 80% de los pacientes tiene dificultades para dormir, sobre todo para mantener el sueño, con múltiples despertares que aprovecha para rumiar sus problemas. Muchos pacientes han perdido el apetito, con la consecuente pérdida de peso, tienen irregularidades con la menstruación y han perdido el interés por las relaciones sexuales. La ansiedad es un síntoma común en la depresión, que afecta a un 90% de los pacientes y, entre los síntomas cognitivos, destacan la sensación subjetiva de dificultades para la concentración y otras alteraciones en los procesos del pensamiento.
Por su parte, el trastorno distímico o distimia es el prototipo de depresión crónica e insidiosa que no alcanza la intensidad suficiente para cumplir los criterios diagnósticos de episodio depresivo mayor. Por lo tanto, las diferencias con la DM son de intensidad y duración más que categoriales, siendo práctica habitual el doble diagnóstico en un mismo paciente. El trastorno distímico puede iniciarse a cualquier edad. Finalmente, el trastorno ciclotímico es un trastorno bifásico caracterizado por oscilaciones bruscas de una fase a otra (hipomanía o depresión), donde cada fase dura días, con ánimo normal poco frecuente. Entre un 3 y un 10% de los pacientes psiquiátricos tratados ambulatoriamente puede presentar un trastorno ciclotímico; en la población general, la prevalencia a lo largo de la vida del trastorno se ha estimado en un 1%, igual que con el trastorno bipolar. El trastorno psicológico coexiste con frecuencia con el trastorno límite de la personalidad.
Hay datos que avalan una participación genética en la depresión mayor, en especial en las formas más graves, lo que supone un factor de vulnerabilidad a padecerla ante determinados desencadenantes, como por ejemplo el estrés. El riesgo es mayor en los parientes de primer grado y, de hecho, éstos responden generalmente al mismo antidepresivo. No obstante, no todo el mundo con este componente genético de vulnerabilidad frente a la DM desarrollará la enfermedad. De hecho, no se ha identificado ninguna variación genética única que sea responsable de un aumento sustancial del riesgo de depresión. Se piensa que son necesarios múltiples factores genéticos, junto con factores ambientales, para el desarrollo de DM. Otras patologías psiquiátricas, como la depresión bipolar, la esquizofrenia o el trastorno por déficit de atención, tienen mayor carga genética.
Asimismo, existen evidencias de que las alteraciones a nivel de varios neurotransmisores y de sus vías de comunicación podrían estar implicadas en la fisiopatología de la depresión, especialmente la noradrenalina (NA) y la serotonina (5-HT). En concreto, existe una disminución de los niveles del 3-metoxi-4-hidroxifenilglicol (un metabolito de la NA) en sangre y orina en los pacientes depresivos, además de una disminución de la bomba de recaptación de la 5-HT en las plaquetas. Se han observado, además, niveles bajos de ácido 5-hidroxiindolacético (metabolito de la 5-HT) en pacientes que cometieron suicidio. Aunque de forma menos relevante que NA y 5-HT, también se ha observado que la depleción de dopamina (DA) aumenta el riesgo de depresión.
Asimismo, se ha sugerido la existencia de diferencias en la actividad del transportador de 5-HT (5-HTT) en la depresión unipolar. Concretamente, el gen que codifica el 5-HTT presenta en su región promotora un polimorfismo (5-HTTLPR-s) que aumenta la vulnerabilidad de sufrir depresión unipolar, en presencia de factores estresantes. Asimismo, el polimorfismo del gen que codifica el 5-HTT (forma “l”) se ha asociado a una mejor respuesta al tratamiento con antidepresivos frente a la forma “s” del transportador. Por otra parte, parece existir una correlación entre el aumento de los niveles del 5-HTT en plaquetas y linfocitos y una mejoría en las escalas clínicas de depresión. Además del 5-HTT, varios receptores serotoninérgicos también muestran cambios en la depresión. El receptor 5-HT1A muestra una disminución en la depresión y se sospecha de un papel importante de los receptores 5-HT2 a la luz de su papel en otros trastornos como la esquizofrenia y el trastorno bipolar y de la eficacia antidepresiva de algunos antipsicóticos que actúan sobre dichos receptores.
Varias estructuras prefrontales y límbicas y los circuitos que las interconectan parecen estar implicados en la regulación afectiva. Las áreas implicadas incluyen a la corteza prefrontal ventromedial (VMPFC), la corteza prefrontal orbital lateral (LOPFC), la corteza prefrontal dorsolateral (DLPFC), la corteza cingulada anterior (CAC), el estriado ventral, incluyendo el núcleo accumbens, la amígdala y el hipocampo. En todas estas zonas se han hallado anomalías en pacientes con DM en comparación con controles sanos que sugieren participar en la expresión sintomática de la DM. En el trastorno depresivo mayor estaría afectada la conectividad dinámica entre las estructuras neuroanatómicas involucradas en la regulación del humor y la respuesta al estrés. En este sentido, en la depresión existe una hiperactividad de la VMPFC, lo que se asocia con mayor sensibilidad al dolor, ansiedad, depresión y tensión; mientras que la hipoactividad de la DLPFC puede producir retraso psicomotor, apatía y déficit en atención y memoria de trabajo. Asimismo, se ha detectado una disminución de la comunicación entre la amígdala y regiones de la corteza cingulada, por lo que ésta perdería su capacidad inhibitoria, importante para la regulación emocional, provocándose una mayor disfunción afectiva y motivacional. En consecuencia, las conexiones entre estructuras cognitivas y ejecutivas son hipofuncionantes, por lo que no controlan las áreas límbicas y éstas estimulan el hipotálamo, lo que conduce a una disregulación neuroendocrina y una hiperactividad simpática, características presentes en la depresión.
Finalmente, existen numerosos factores de riesgo psicológicos y sociales reconocidos para la depresión. Entre los más reconocidos se encuentra una baja autoestima, experiencias adversas en la infancia, patrones de pensamiento negativo y un exceso de acontecimientos vitales recientes no deseables, como los que suponen algún tipo de pérdida: un divorcio, la muerte de un ser querido, etc. Asimismo, la existencia de dificultades importantes persistentes, como el desempleo, la pobreza, etc., son factores de riesgo para padecer depresión. Determinados rasgos de personalidad, como hiperresponsabilidad, honestidad, autoexigencia, poca tolerancia, inseguridad, escrupulosidad, escasa flexibilidad, pesimismo, dependencia, baja autoestima e influenciabilidad, se consideran también factores de riesgo depresivo. Y sin olvidar que determinadas enfermedades orgánicas o psiquiátricas asociadas pueden inducir depresión.
El tratamiento de la DM incluye la fase aguda (dirigida a obtener la remisión), la fase de continuación (se mantiene la remisión y se previenen las recaídas) y la fase de mantenimiento (orientada a prevenir la recidiva). Los objetivos generales del tratamiento son:
- Reducir y eliminar los síntomas depresivos.
- Recuperar el funcionamiento biopsicosocial y laboral del paciente.
- Disminuir el riesgo de suicidio.
- Minimizar la morbilidad reduciendo recaídas o cronicidad.
- Prevenir la comorbilidad.
- Prevención de recaídas depresivas.
- Mejorar la relación beneficio-riesgo de la medicación en relación con la patología.
En el tratamiento de la depresión se utiliza una familia de psicofármacos, los antidepresivos, heterogénea en cuanto a su estructura química y efectos sobre la neurotransmisión cerebral. En líneas generales, la eficacia de los antidepresivos varía poco entre los diferentes grupos, diferenciándose entre ellos fundamentalmente por sus perfiles de seguridad, tolerabilidad e interacciones.
En depresiones graves, los antidepresivos constituyen el único tratamiento para el que se ha encontrado una clara evidencia de efectividad, ya sean solos o en combinación con psicoterapia. Sin embargo, en depresiones más leves o moderadas, los antidepresivos, pese a ser eficaces, invitan a pensar en la posibilidad de emplear altetrnativamente estrategias de psicoterapia, que también gozan de eficacia.
Existen algunos factores que pueden orientar la elección del antidepresivo. Así, por ejemplo, si un paciente –o un familiar de primer grado– ha respondido previamente a un determinado antidepresivo, se recomienda emplear el mismo fármaco que ha demostrado utilidad. Por otro lado, hay autores que apoyan una mayor eficacia de los antidepresivos tricíclicos (ADT) y, posiblemente, de los antidepresivos duales (venlafaxina y duloxetina) en la DM melancólica, cuadro caracterizado por presentar una mayor endogeneidad. En el caso de una DM con síntomas atípicos o una distimia, los inhibidores selectivos de la recaptación de serotonina (ISRS) podrían ser preferibles a los ADT. Por otro lado, algunos efectos secundarios de los antidepresivos, como la sedación y el aumento del apetito, pueden resultar útiles si el episodio cursa con agitación, insomnio y pérdida de apetito.
Los antidepresivos en general aumentan la tasa de monoaminas en la hendidura sináptica, actuando dichas monoaminas sobre distintos receptores, que actuarían a modo de interruptores poniendo en marcha los mecanismos de transducción responsables del efecto antidepresivo. En este sentido, es probable que todos los antidepresivos, independientemente de que “toquen” el interruptor noradrenérgico o serotoninérgico, desarrollen su efecto molecular a través de una vía final común. Sin embargo, se han descrito cuadros depresivos específicamente relacionados con un déficit funcional serotoninérgico, que cursa con ánimo deprimido, ansiedad, crisis de pánico, fobias, obsesiones-compulsiones y bulimia, y otros que guardan relación con un déficit noradrenérgico, caracterizado por ánimo deprimido, déficits cognitivos (atención, memoria de trabajo y velocidad de procesamiento de la información), inhibición psicomotriz, cansancio y apatía. Cuando estos cuadros son muy claros, se podría intentar de inicio abordar el tratamiento deficitario serotoninérgico con potenciadores de estos mecanismos, por ejemplo, ISRS (fluoxetina, paroxetina, etc.) y, por el contrario, en caso de déficit noradrenérgico se podría iniciar el tratamiento con un inhibidor de la recaptación de NA (IRNA) como, por ejemplo, reboxetina. No obstante, se ha observado que estas vías se estimulan mutuamente, lo que dificulta predecir la eficacia específica a través del mecanismo de acción de cada fármaco.
La tolerabilidad a los efectos secundarios es otro criterio y con seguridad más empleado que el del mecanismo de acción para la elección del antidepresivo. Los ISRS y los antidepresivos más modernos parecen tener un perfil de seguridad algo mejor y se toleran generalmente mejor que el de los más antiguos, por lo que suelen ser los agentes de primera elección en el tratamiento de la depresión leve y moderada. Para la elección del antidepresivo se debe considerar también la posibilidad de interacciones con otros fármacos. Casi todos los antidepresivos, con la excepción de la agomelatina, inhiben en mayor o menor medida diversos isoenzimas del citocromo P450 (CYP), como la CYP2D6, mientras que los ISRS, con la excepción del escitalopram, inhiben además otras como CYP3A4, CYP1A2, CYP2C9 o CYP2C19.
La variabilidad interindividual en la respuesta terapéutica a los fármacos antidepresivos es muy amplia. En el tratamiento de la DM se suelen distinguir 3 fases: aguda, de continuación y de mantenimiento, durante las que el tratamiento muestra su eficacia produciendo inicialmente una “respuesta”, que se considera cuando se observa una mejoría en la intensidad de los síntomas de un 50% en las escalas clínicas empleadas (las más comunes son la Escala de Hamilton – HDRS: Hamilton Depression Rating Scale – y la de Montgomery-Asberg – MADRS: Montgomery-Asberg Depression Rating Scale). Posteriormente, se produce la “remisión” de la enfermedad, caracterizada por que el paciente presenta un estado afectivo normal y muy parecido al que exhibía antes de presentarse la depresión. Cuando la remisión se mantiene en el tiempo, se puede hablar de “recuperación”. Sin embargo, en ocasiones se producen “recaídas”, cuando el sujeto vuelve a mostrar síntomas depresivos antes de la recuperación, o se produce una “recurrencia”, cuando el sujeto vuelve de nuevo a la depresión tras haberse producido la recuperación.
El objetivo durante la fase aguda es suprimir todos los signos y síntomas del episodio en curso, restaurando la funcionalidad psicosocial y ocupacional. Esta fase abarca las primeras semanas de tratamiento, hasta que el paciente alcanza una respuesta clínica significativa, que usualmente es de al menos un 40-60% de mejoría en los síntomas. Se considera que aproximadamente las dos terceras partes de los pacientes con depresión responden aceptablemente al tratamiento con antidepresivos. Un tercio tiene una respuesta gradual y suele manifestarse entre la segunda y la sexta semana del inicio del tratamiento, mientras que el otro tercio tiene una respuesta más lenta, parcial o con síntomas residuales que sugieren replantearse el tratamiento aumentando la dosis o añadiendo algún otro fármaco (ansiolítico, antipsicótico, etc.). Finalmente, otro tercio de los pacientes no tiene ninguna respuesta al tratamiento inicial, lo que obliga a un cambio del antidepresivo. En términos estrictos, no se puede hablar de falta de respuesta o resistencia al tratamiento antidepresivo hasta transcurridas 8 semanas de tratamiento y habiéndose alcanzado la dosis máxima del fármaco utilizado.
El objetivo de la fase de continuaLUNDBECKción se centra en prevenir las recaídas, manteniendo la respuesta inicial. Es importante destacar que tras el cese de los síntomas agudos de depresión, si se interrumpe la terapia de forma inmediata, hasta dos tercios de los pacientes pueden experimentar una recaída. Se considera al paciente recuperado cuando ha permanecido asintomático durante al menos 4 a 9 meses tras el último episodio depresivo. Una vez alcanzada la recuperación, el tratamiento de continuación puede interrumpirse, recomendándose un periodo de entre 6 y 12 meses para evitar las recurrencias. En definitiva, cuando la remisión se mantiene de 6 a 12 meses, se habla de recuperación y el paciente entra en la fase de mantenimiento, cuyo objetivo es prevenir un nuevo episodio de depresión. Su duración podría oscilar desde 1 año a toda la vida del sujeto, dependiendo de la probabilidad de recurrencias.
ACCIÓN Y MECANISMO
La vortioxetina es un agente antidepresivo que actúa genéricamente modulando la actividad y el transporte de la serotonina (5-HT), a través de la activación o el bloqueo de varios tipos de receptores serotonérgicos y de la inhibición del transportador de serotonina; sin embargo, no se conoce en qué medida cada uno los efectos bioquímicos es responsable de la actividad antidepresiva y ansiolítica manifestada por el fármaco. El medicamento ha sido autorizado oficialmente para el tratamiento de episodios de depresión mayor en adultos.
La vortioxetina ha mostrado actividad específica como bloqueador del transportador de serotonina (5-HHT) y de los receptores serotonérgicos 5-HT3, 5-HT7 y 5-HT1D; en cambio es un agonista del receptor 5-HT1A y agonista parcial del receptor 5-HT1B. En concentraciones similares a las plasmáticas obtenidas tras la administración de dosis terapéuticas, solo las afinidades de unión al receptor 5-HT3 y al transportador 5-HTT son consideradas como terapéuticamente relevantes. En cualquier caso, este amplio perfil bioquímico es capaz de afectar no solo a la actividad neurológica de la serotonina sino también a la de otros neurotransmisores a nivel central: noradrenalina, dopamina, histamina, acetilcolina, GABA y glutamato.
ASPECTOS MOLECULARES
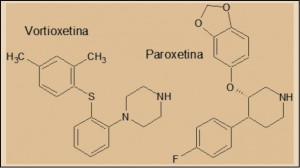
La vortioxetina forma parte de la serie química de las bis-aril-sulfanil aminas. No obstante, es evidente la existencia de una significativa familiaridad química – y farmacológica – con otros antidepresivos, especialmente inhibidores de la recaptación de serotonina y/o de noradrenalina; en este sentido, cabe indicar la marcada proximidad de la vortioxetina con la paroxetina. Como otros muchos fármacos antidepresivos, la vortioxetina presenta una cadena típica aril-propil amina secundaria, aunque en este caso “enmascarada” en un agrupamiento fenilpiperazínico.
Es importante tener en cuenta que los antidepresivos forman un amplísimo conjunto de fármacos con perfiles bioquímicos muy complejos, en los que participan diversos receptores de múltiples neurotransmisores y muchos de sus sistemas de transporte y recaptación neuronal. La clasificación en grupos (inhibidores de la recaptación de serotonina, etc.) es meramente orientativa, ya que, en realidad, no puede establecerse una pauta bioquímica única (un marcador biológico) que se relacione explícitamente con la actividad antidepresiva (ni con la ansiolítica, manifestada en algunos antidepresivos). Por este motivo, hablar de “un nuevo grupo de antidepresivos” para la vortioxetina puede resultar, cuando menos, arriesgado.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas de la vortioxetina han sido adecuadamente contrastadas en la indicación autorizada mediante varios ensayos clínicos de fase 3 (confirmatorios de eficacia y seguridad), aleatorizados, multicéntricos, doblemente ciegos y controlados con placebo y comparadores activos (venlafaxina, dulotexina, agomelatina), de corta duración (6-12 semanas), aunque en algún caso con extensiones abiertas. Los pacientes incluidos en los ensayos presentaban depresión leve a intensa con una puntuación de al menos 22 puntos según la escala MADRS1y una duración del episodio depresivo de al menos tres meses.
La variable primaria de eficacia utilizada en estos estudios fue la variación (reducción) de la puntuación de la depresión según la MADRS al final del estudio (6-12 semanas). Como variables secundarias de eficacia se determinaron las variaciones en las escalas HDRS2 (HAM-D24) y de la escala clínica global de impresión de la gravedad de la enfermedad (Clinical Global Impressions of Illness, CGI-I), así como la tasa de respondedores (porcentaje pacientes que experimentaron una reducción de al menos un 50% en la puntuación MADRS al final del estudio); también se estudió el efecto sobre la calidad de vida de los pacientes mediante el cuestionario SF-363 y la escala de discapacidad de Sheean (Sheehan Disability Scale, SDS)4. Las características y resultados de los ensayos clínicos controlados con comparadores activos están recopilados en la tabla 1.
|
Tabla 1. Estudios clínicos de fase 3 con vortioxetina controlados con placebo y comparadores activos |
||||
|
Tratamientos comparados |
Vortioxetina 5 mg/día Vortioxetina 10 mg/día Venlafaxina 225 mg/día Placebo |
Vortioxetina 2,5 mg/día Vortioxetina 5 mg/día Vortioxetina 10 mg/día Duloxetina 60 mg/día Placebo |
Vortioxetina 15 mg/día Vortioxetina 20 mg/día Duloxetina 60 mg/día Placebo |
Vortioxetina 15 mg/día Vortioxetina 20 mg/día Duloxetina 60 mg/día Placebo |
|
Pacientes aleatorizados |
429 |
776 |
608 |
614 |
|
Duración estudio |
6 semanas |
8 semanas |
8 semanas |
8 semanas |
|
Variación de la puntuación MADRS |
Vortioxetina (5): -20,40 Vortioxetina (10): -20,20 Venlafaxina (225): -20,92 Placebo: -14,50 |
Vortioxetina (2,5): -16,2 (ns) Vortioxetina (5): -16,5 (ns) Vortioxetina (10): -16,3 (ns) Duloxetina (60): -16,8 (ns) Placebo: -14,8 |
Vortioxetina (15): -17,23 Vortioxetina (20): -18,79 Duloxetina (60): -21,15 Placebo: -11,70 |
Vortioxetina (15): -14,30 (ns) Vortioxetina (20): -15,57 Duloxetina (60): -16,90 Placebo: -12,83 |
|
Variación de la puntuación HAM-D24 |
|
|
|
|
|
Tasa de respuesta (% pacientes con reducción ≥50% puntuación MADRS) |
Vortioxetina (5): 66,7% Vortioxetina (10): 68,0% Venlafaxina (225): 72,3% Placebo: 44,8% |
Vortioxetina (2,5): 54,2% (ns) Vortioxetina (5): 56,1% (ns) Vortioxetina (10): 57,6% (ns) Duloxetina (60): 57,1% (ns) Placebo: 46,9% |
Vortioxetina (15): 57,0% Vortioxetina (20): 61,6% Duloxetina (60): 74,0% Placebo: 32,3% |
Vortioxetina (15): 44,1% (ns) Vortioxetina (20): 44,2% (ns) Duloxetina (60): 54,8% Placebo: 39,2% |
|
Tasa de respuesta (% pacientes con reducción ≥50% puntuación HAM-D24) |
|
|
|
|
|
Tasa de remisión (% pacientes con puntuación MADRS ≤10) |
Vortioxetina (5): 49,1% Vortioxetina (10): 49,0% Venlafaxina (225): 55,4% Placebo: 26,7% |
Vortioxetina (2,5): 32,9% (ns) Vortioxetina (5): 36,1% (ns) Vortioxetina (10): 35,8% (ns) Duloxetina (60): 34,9% (ns) Placebo: 33,8% |
Vortioxetina (15): 34,9% Vortioxetina (20): 38,4% Duloxetina (60): 54,1% Placebo: 19,0% |
Vortioxetina (15): 26,9% (ns) Vortioxetina (20): 29,3% (ns) Duloxetina (60): 26,0% (ns) Placebo: 26,8% |
|
Variación de la puntuación CGI-I |
Vortioxetina (5): 2,05 Vortioxetina (10): 2,04 Venlafaxina (225): 1,96 Placebo: 2,64 |
Vortioxetina (2,5): 2,32 (ns) Vortioxetina (5): 2,32 (ns) Vortioxetina (10): 2,35 (ns) Duloxetina (60): 2,31 (ns) Placebo: 2,52 |
Vortioxetina (15): 2,18 Vortioxetina (20): 1,92 Duloxetina (60): 1,75 Placebo: 2,86 |
Vortioxetina (15): 2,54 (ns) Vortioxetina (20): 2,47 (ns) Duloxetina (60): 2,31 Placebo: 2,65 |
|
Variación de la puntuación SF-36 |
Vortioxetina (5): 7,97 (ns) Vortioxetina (10): 8,89 (ns) Venlafaxina (225): 9,10 (ns) Placebo: 6,53 |
|
|
|
|
Variación de la puntuación SDS |
|
Vortioxetina (2,5): -7,10 (ns) Vortioxetina (5): -6,52 (ns) Vortioxetina (10): -7,81 (ns) Duloxetina (60): -7,91 (ns) Placebo: -6,11 |
Vortioxetina (15): -7,70 Vortioxetina (20): -8,38 Duloxetina (60): -11,39 Placebo: -4,46 |
Vortioxetina (15): -7,73 (ns) Vortioxetina (20): -8,55 (ns) Duloxetina (60): -9,66 (ns) Placebo: -7,68 |
|
Referencia |
11429A (EMA, 2014) |
11984A (EMA, 2014) |
13267A (EMA, 2014) |
315 (EMA, 2014) |
Nota: Todas las diferencias de las variables observadas con los tratamientos activos con relación al placebo fueron estadísticamente significativas (p<0,05), salvo aquellas notadas con (ns).
|
Tabla 1 (continuación). Estudios clínicos de fase 3 con vortioxetina controlados con placebo y comparadores activos |
|||
|
Tratamientos comparados |
Vortioxetina 2,5 mg/día Vortioxetina 5 mg/día Duloxetina 60 mg/día Placebo |
Vortioxetina 5 mg/día Duloxetina 60 mg/día Placebo |
Vortioxetina 10-20 mg/día Agomelatina 25-50 mg/día |
|
Pacientes aleatorizados |
611 |
453* |
501** |
|
Duración estudio |
8 semanas |
8 semanas |
12 semanas |
|
Variación de la puntuación MADRS |
Vortioxetina (2,5): -11,61 (ns) Vortioxetina (5): -11,30 (ns) Duloxetina (60): -14,10 Placebo: -11,22 |
Vortioxetina (5): -15,5 Duloxetina (60): -18,0 Placebo: -11,2 |
Vortioxetina (10/20): -16,5 Agomelatina (25/50): -14,4 |
|
Variación de la puntuación HAM-D24 |
Vortioxetina (2,5): -12,04 (ns) Vortioxetina (5): -11,08 (ns) Duloxetina (60): -13,47 Placebo: -10,50 |
Vortioxetina (5): -13,7 Duloxetina (60): -15,8 Placebo: -10,3 |
Vortioxetina (10/20): -13,52 Agomelatina (25/50): -11,59 |
|
Tasa de respuesta (% pacientes con reducción ≥50% puntuación MADRS) |
|
Vortioxetina (5): 60% Duloxetina (60): 71% Placebo: 36% |
|
|
Tasa de respuesta (% pacientes con reducción ≥50% puntuación HAM-D24) |
Vortioxetina (2,5): 41,1% (ns) Vortioxetina (5): 37,9% (ns) Duloxetina (60): 51,0% Placebo: 32,2% |
Vortioxetina (5): 53% Duloxetina (60): 63% Placebo: 35% |
|
|
Tasa de remisión (% pacientes con puntuación MADRS ≤10) |
Vortioxetina (2,5): 33,0% (ns) Vortioxetina (5): 26,7% (ns) Duloxetina (60): 46,4% Placebo: 27,7% |
Vortioxetina (5): 34% Duloxetina (60): 47% Placebo: 21% |
Vortioxetina (10/20): 55,2% Agomelatina (25/50): 39,4% |
|
Variación de la puntuación CGI-I |
Vortioxetina (2,5): 2,73 (ns) Vortioxetina (5): 2,63 (ns) Duloxetina (60): 2,39 Placebo: 2,79 |
Vortioxetina (5): 2,35 Duloxetina (60): 2,07 Placebo: 2,91 |
Vortioxetina (10/20): -2,20 Agomelatina (25/50): -1,93 |
|
Variación de la puntuación SF-36 |
|
|
|
|
Variación de la puntuación SDS |
Vortioxetina (2,5): -6,46 (ns) Vortioxetina (5): -6,59 (ns) Duloxetina (60): -8,91 Placebo: -6,83 |
|
Vortioxetina (10/20): -10,99 Agomelatina (25/50): -9,24 |
|
Referencia |
304 (EMA, 2014) |
12541A (EMA, 2014) |
14178A (EMA, 2014) |
Nota: Todas las diferencias de las variables observadas con los tratamientos activos con relación al placebo fueron estadísticamente significativas (p<0,05), salvo aquellas notadas con(ns).
* Pacientes ancianos.
** Pacientes con respuesta inadecuada a un tratamiento antidepresivo previo.
Desde el punto de vista de la seguridad, la vortioxetina presenta un perfil toxicológico relativamente benigno, equiparable al de los agentes antidepresivos inhibidores de la recaptación de serotonuina y/o noradrenalina, con eventos adversos leves o moderados, de corta duración y mayoritariamente producidos durante las dos primeras semanas de tratamiento, con predominio de los gastrointestinales (especialmente en las mujeres). En general, con las dosis autorizadas (5-20 mg/día), los eventos adversos más comunes fueron las náuseas, que afectan a un tercio de los pacientes (más o menos como duloxetina y venlafaxina); también se han descrito con frecuencia (>10%) cefalea, mareo, diarrea o estreñimiento, y vómitos. Con menos frecuencia se han descrito pesadillas o sueños anómalos, anorexia y prurito. Como ocurre con otros antidepresivos relacionados, es frecuente la aparición de acontecimientos adversos de naturaleza sexual (disminución de la libido, retardo en la eyaculación, disfunción eréctil en varones, etc.), con una frecuencia del 38% (48% con duloxetina y 32% con placebo).
Por lo que respecta a la aparición de ideas suicidas – frecuentes entre los pacientes deprimidos – la incidencia descrita en los ensayos clínicos controlados con placebo y controladores activos es del orden del 0,5%, prácticamente igual que con placebo; aunque se ha reportado tasas sustancialmente mayores (en torno al 10%) en estudios abiertos, también ocurre lo mismo con placebo (12%).
La frecuencia de eventos adversos intensos (severos) emergentes durante el tratamiento fue del 0-1,6% (en orden creciente con las dosis) vs. 0,9-3,7% con placebo. Los porcentajes de pacientes que suspendieron el tratamiento por este motivo fueron del 4,1-7,8% con vortioxetina, del 8,8% con duloxetina y del 3,6% con placebo.
ASPECTOS INNOVADORES
La vortioxetina es un agente antidepresivo que actúa genéricamente modulando la actividad y el transporte de la serotonina (5-HT), a través de la activación o el bloqueo de varios tipos de receptores serotonérgicos y de la inhibición del transportador de serotonina. Este amplio perfil bioquímico es capaz de afectar no solo a la actividad neurológica de la serotonina sino también a la de otros neurotransmisores a nivel central: noradrenalina, dopamina, histamina, acetilcolina, GABA y glutamato. Aunque no se conoce en qué medida cada uno los efectos bioquímicos es responsable de la actividad antidepresiva y ansiolítica manifestada por el fármaco, los efectos bloqueantes sobre el receptor 5-HT3 y el transportador 5-HTT son considerados globalmente como los más relevantes terapéuticamente. El medicamento ha sido autorizado oficialmente para el tratamiento de episodios de depresión mayor en adultos.
Los ensayos clínicos controlados han demostrado un efecto neto significativamente superior al placebo, no solo en el tratamiento de los episodios de depresión mayor sino también en la prevención de recaídas de los mismos, con datos procedentes de extensiones abiertas que permiten afirmar que el fármaco mantiene su eficacia al menos durante un año. En un amplio metanálisis (Pae, 2015) se demostró que la vortioxetina era significativamente más eficaz que el placebo, con un tamaño de efecto (diferencia media estandarizada) de -0,217 (IC95% -0,313 a -0,122) y con un coeficiente de disparidad (odds ratio, OR) de 1,652 (IC95% 1,321 a 2,067) para la respuesta y de 1,399 (IC95% 1,104 a 1,773) para la remisión. Asimismo, la tasa de abandonos del tratamiento por falta de eficacia fue significativamente menos común con vortioxetina (OR=0,541; IC95% 0,308 a 0,950), mientras que la de abandonos del tratamiento por eventos adversos fue más común (OR=1,530; IC95% 1,144 a 2,047).
Por lo que respecta a la comparación con otros antidepresivos en los ensayos clínicos controlados, la vortioxetina no mostrado superioridad sobre venlafaxina o duloxetina (más bien, la tendencia fue a la inversa), aunque sí sobre la agomelatina en pacientes previamente tratados de forma insatisfactoria con otros antidepresivos. A este respecto, un reciente metanálisis (Citrome, 2016) ha comparado de forma indirecta los resultados clínicos de la vortioxetina con los de dos antidepresivos inhibidores selectivos de la recaptación de serotonina (sertralina y escitalopram) y dos inhibidores de la recaptación de serotonina y noradrenalina (venlafaxina y duloxetina), estableciendo el número de pacientes que es necesario tratar (NNT)5, número necesario para causar daño (NNH)6 y la probabilidad de experimentar un beneficio con relación a la de padecer un perjuicio (LHH)7.
De acuerdo con los resultados de este metanálisis, el NNT de la vortioxetina fue de 9 (IC95% 7 a 11) vs. 6 (IC95% 5 a 8) con duloxetina, 7 (IC95% 5 a 11) con excitalopram, 6 (IC95% 4 a 13) con sertralina y 6 (IC95% 5 a 9) con venlafaxina. Por lo que respecta al NNH, los valores fueron de 43 (IC95% 28 a 91) con vortioxetina vs. 25 (IC95% 17 a 51) con duloxetina, 31 (IC95% 19 a 92) con excitalopram, 7 (IC95% 5 a 12) con sertralina y 27 (IC95% 15 a 104) con venlafaxina. Finalmente, los valores correspondiente al LHH fueron de 5,1 con vortioxetina vs. 4,3 con duloxetina, 4,6 con excitalopram, 1,2 con sertralina y 1,4 con venlafaxina. Todo ello parece sugerir una eficacia levemente inferior a los comparadores estándar y, en cambio, una tolerabilidad ligeramente mayor. No obstante, debe tenerse presente que al tratarse de comparaciones indirectas, los resultados deben ser tomados con mucha prudencia dado que los perfiles psiquiátricos, antropométricos y de comorbilidad de los pacientes participantes en cada ensayo clínico pueden no ser superponibles; todo ello determina que este tipo de comparaciones solo tiene un carácter meramente orientativo.
Según el Informe de Posicionamiento Terapéutico (AEMPS, 2015), la vortioxetina representa una alternativa más entre las actualmente disponibles para el tratamiento de la depresión, pero sin que represente una ventaja en cuanto a su eficacia antidepresiva.
Por otro lado, se ha apuntado que la vortioxetina sería el primer representante de un nuevo grupo de antidepresivos, por la particularidad de su mecanismo de acción y por formar parte de una nueva serie química; pero ni lo uno ni lo otro puede aceptarse, al menos sin las debidas matizaciones. En este sentido, es importante tener en cuenta que los antidepresivos forman un amplísimo conjunto de fármacos con perfiles bioquímicos muy complejos, en los que participan diversos receptores de múltiples neurotransmisores y muchos de sus sistemas de transporte y recaptación neuronal. La clasificación en grupos (inhibidores selectivos de la recaptación de serotonina, etc.) es meramente orientativa, ya que, en realidad, no puede establecerse una pauta bioquímica única (un marcador biológico) que se relacione explícitamente con la actividad antidepresiva (ni con la ansiolítica, manifestada en algunos antidepresivos). Por otro lado, químicamente, la vortixetina muestra una evidente familiaridad química con otros antidepresivos, tales como la paroxetina. Por estos motivos, afirmar que la vortioxetina “inaugura un nuevo grupo de antidepresivos” puede resultar, cuando menos, arriesgado.
En definitiva, un nuevo antidepresivo más a agregar al nutrido grupo de fármacos útiles para afrontar la depresión mayor, pero sin ninguna ventaja o innovación aparente sobre los actualmente disponibles.
|
VALORACIÓN |
|
VORTIOXETINA
|
|
Grupo Terapéutico (ATC): N06AX. SISTEMA NERVIOSO. Antidepresivos: Otros. |
|
Indicaciones autorizadas: Tratamiento de episodios de depresión mayor en adultos. |
|
sin INNOVACIÓN. No implica aparentemente ninguna mejora farmacológica ni clínica en el tratamiento de las indicaciones autorizadas. |
BIBLIOGRAFÍA
2 La escala de puntuación de la depresión de Hamilton (Hamilton Depression Rating Scale; HDRS) mide la gravedad de la depresión y permite monitorizar la evolución de los síntomas. Incluye hasta 24 ítems (HDRS24), aunque es frecuente utilizar versiones abreviadas como la HDRS17, entre los que se incluyen ánimo depresivo, sentimientos de culpa, suicidio, insomnio precoz, medio y tardío, trabajo y actividades, inhibición, agitación, ansiedad psíquica y ansiedad somática, síntomas somáticos gastrointestinales, síntomas somáticos generales, síntomas sexuales (disfunción sexual y alteraciones de la menstruación), hipocondría, pérdida de peso y capacidad de entendimiento. La puntuación global se obtiene sumando las puntuaciones de cada ítem, con un rango de puntuación que en la versión española es de 0 (ausencia completa de ningún síntoma depresivo) a 54 (gravedad máxima). Habitualmente, se considera que hay depresión a partir de 8 puntos, considerándose como leve hasta los 13, moderada entre 14 y 18, grave de 19 a 22 y muy grave por encima de 22.
3 El SF-36 es un cuestionario genérico de 36 ítems que mide la salud autopercibida en ocho dimensiones: función física (FF), función social [FS], rol físico [RF], rol emocional [RE], salud mental [SM], vitalidad [VT], dolor corporal [DC] y salud general [SG]. Todos ellos pueden resumirse en dos componentes sumarios de salud física (CSF) y salud mental (CSM). Las puntuaciones van desde 0 a 100, siendo 100 la mejor calidad de vida percibida.
4 La SDS es un cuestionario para determinar el grado de deterioro funcional en tres dominios interrelacionados: trabajo/actividad escolar, relaciones sociales y vida familiar. Cada dominio es puntuado de 0 a 10 (0 indica la ausencia absoluta de deterioro y 10 un deterioro máximo), totalizando un máximo de 30 punto (completamente deteriorado funcionalmente). En ocasiones, esta escala numérica es convertida en porcentual (0-30 = 0-100% de deterioro).
5 Elnúmero de pacientes que es necesario tratar o NNT(number needed to treat) es el reciproco de la reducción del riesgo absoluto (RRA) y describe la diferencia entre un tratamiento activo y un control en lo que se refiere a lograr un resultado clínico concreto (NNT= 1/RRA). Idealmente, un NNT de 1 significa que en todos los pacientes a los que se les da el tratamiento se produce un resultado favorable, a la vez que ningún paciente del grupo de comparación tiene el resultado esperado; por lo tanto, cuanto más pequeño sea el NNT (siempre ≥1), tanto mayor es la eficacia comparada.
6 El NNH (number needed to harm) es el número necesario de pacientes que hay que tratar para que un paciente sufra un evento adverso. Cuanto mayor sea este número, tanto menor es el riesgo de experimentar algún evento adverso y, por tanto, indica que el tratamiento es mejor tolerado por los pacientes.
7 La LHH (likelihood to be helped or harmed) representa probabilidad (expresada en tanto por 1 o veces) de experimentar un beneficio con relación a la de padecer un perjuicio, contrastando eficacia con tolerabilidad. Cuando mayor sea el valor, tanto mejor es la relación beneficio/riesgo.
Bibliografía
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de Posicionamiento Terapéutico de vortioxetina (Brintellix®). Fecha de publicación: 22 de julio de 2015. http://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-vortioxetina-brintellix.pdf
- Citrome L.Vortioxetine for major depressive disorder: An indirect comparison with duloxetine, escitalopram, levomilnacipran, sertraline, venlafaxine, and vilazodone, using number needed to treat, number needed to harm, and likelihood to be helped or harmed. J Affect Disord. 2016; 196: 225-233. doi: 10.1016/j.jad.2016.02.042.
- Consejo General de Colegios Oficiales de Farmacéuticos.Bot PLUS WEB.https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S. Tianeptina (Zinosal®) en depresión. Panorama Actual Med 2015; 39(383): 395-401.
- European Medicines Agency (EMA). Brintellix®.European Public Assessment Report (EPAR). EMA/9495/2014; EMEA/H/C/002717.http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002717/WC500159447.pdf
- Gabilondo A, Rojas-Farreras S, Vilagut G, Haro JM, Fernández A, Pinto-Meza A, et al. Epidemiology of major depressive episode in a southern European country: Results from the ESEMeD-Spain project. J Affect Disord. 2010; 120(1-3): 76-85.
- Pae CU, Wang SM, Han C, Lee SJ, Patkar AA, Masand PS, Serretti A.Vortioxetine: a meta-analysis of 12 short-term, randomized, placebo-controlled clinical trials for the treatment of major depressive disorder. J Psychiatry Neurosci. 2015; 40(3): 174-86.
1 La escala de puntuación de la depresión de Montgomery-Asberg (Montgomery-Asberg Depression Rating Scale, MADRS) está formada por 10 ítems correspondientes a 10 síntomas depresivos distintos, cada uno de los cuales es evaluado mediante una subescala con 7 niveles de gravedad, de 0 (ausencia del síntoma) a 6 (máximo nivel de gravedad del síntoma). Sumando las puntuaciones parciales de cada ítem se obtiene la puntuación global de la escala, que oscila entre 0 (ausencia de depresión) y 60 puntos (máximo nivel de depresión). Se considera que una puntuación de 10 o más puntos indica la presencia de un trastorno depresivo.
Artículos relacionados
-
27 Feb 2026Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
23 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares





