Nalmefeno SELINCRO® (Lundbeck)
 Nº378
Nº378
Resumen
El nalmefeno (Selincro®) es un modulador del sistema opioide endógeno, con efectos antagonistas sobre los receptores µ y d, y agonista parcial sobre los k, contrarrestando los efectos reforzantes del consumo de alcohol sobre los circuitos neurológicos de recompensa, reduciendo dicho consumo, al modular las funciones del sistema cortico-mesolímbico cerebral. Ha sido autorizado para la reducción del consumo de alcohol en pacientes adultos con dependencia del alcohol que presentan un nivel de consumo de alcohol de alto riesgo, sin síntomas de abstinencia físicos y que no requieran una desintoxicación inmediata. En estos pacientes (más de 60 g/día de alcohol para varones y más de 40 para mujeres), se aprecia una reducción de más del 50% en el número de días de consumo elevado de alcohol al mes y en la cantidad total de alcohol ingerida. Los eventos adversos más comunes son náuseas, insomnio, mareos y cefalea, algunos de ellos indistinguibles de los síntomas asociados a la reducción del consumo de alcohol en personas muy dependientes de ellos. Ciertamente, no parece que el nalmefeno mejore el tratamiento de la dependencia alcohólica, dominado fundamentalmente por acamprosato y naltrexona, la forma de utilización a demanda puede calificarse como novedoso frente a las limitaciones de las pautas posológicas fijas.
ALCOHOLISMO
La adicción a cualquier sustancia psicoactiva es una patología cerebral que implica cambios funcionales y/o estructurales del cerebro. Se considera una enfermedad crónica, con recaídas, caracterizándose por la búsqueda compulsiva del elemento al que se es adicto (craving), pese a sus consecuencias nocivas. En la actualidad, el término adicción se utiliza para adjetivar conductas con características de dependencia no originadas por sustancias químicas, como el juego, la comida, la televisión, el sexo, etc., donde viene a significar: necesidad imperiosa de llevar a cabo un comportamiento que no tiene en cuenta las consecuencias nocivas para el individuo y su entorno familiar, laboral y social. La drogodependencia integra elementos físicos (consecuencia de fenómenos neuroadaptativos), psicológicos (cambios en el comportamiento) y sociales. La dependencia física se define como un estado caracterizado por la necesidad de mantener unos niveles determinados de una droga en el organismo, desarrollándose un vínculo droga-organismo. Sus dos componentes principales son la tolerancia y el síndrome de abstinencia agudo o de retirada.
La tolerancia se considera un fenómeno adaptativo del organismo, que con el consumo continuado de una sustancia psicoactiva (como el alcohol) pierde sensibilidad a la misma, lo que implica la necesidad de aumentar la dosis para conseguir el mismo efecto. El síndrome de abstinencia agudo (o de retirada) se presenta cuando se suspende bruscamente la administración de la sustancia psicoactiva (abstinencia por supresión) o bien se administra un antagonista (abstinencia precipitada) y cursa con una serie de signos y síntomas físicos y psíquicos de gravedad y perfil variable, según la sustancia, los cuales ceden con la administración de ésta o de sus sustitutos farmacológicos.
La dependencia psicológica o craving es el deseo irresistible de repetir la administración de la sustancia para obtener la vivencia de sus efectos placenteros y/o evasivos y/o evitar el malestar de privación. Se trata de un fenómeno dinámico que varía de unas personas a otras y que incluso en una misma persona es diferente según la situación y el tiempo de evolución de la dependencia. Sin duda, constituye uno de los principales obstáculos para el mantenimiento de la abstinencia una vez que ésta se ha conseguido. La dependencia social está determinada por la necesidad de consumir la sustancia como signo de pertenencia a un grupo social que proporciona una clara señal de identidad personal y, en el caso de alcohol y el tabaco, tiene una gran relevancia por tratarse de drogas de carácter legal (aunque otras, como la cocaína o la marihuana, también tienen importantes connotaciones sociales, a pesar de ser actualmente ilegales).
En definitiva, la drogodependencia es una enfermedad crónica y recurrente que se caracteriza por la búsqueda y el consumo compulsivo de la sustancia psicológica pese a sus consecuencias nocivas, la pérdida del control de la administración y la aparición de estados emocionales negativos (disforia, ansiedad, irritabilidad) cuando no se tiene acceso a la misma. En general, el consumo de drogas está más extendido entre los hombres que entre las mujeres. La edad media de inicio se mantiene estable en los últimos años, siendo las drogas de inicio más temprano las bebidas alcohólicas (13,7 años), junto con el tabaco y los inhalables volátiles (13,5 y 13,2 años, respectivamente) (Alarcón de Lastra, 2013).
El alcohol es la sustancia psicoactiva más consumida en nuestro medio, seguido del tabaco, el cannabis, la cocaína, el éxtasis y los alucinógenos, y los opiáceos. La mayoría de la población española consume bebidas alcohólicas esporádica o habitualmente; en la población de 15 a 64 años la tendencia temporal de la prevalencia de consumo de bebidas alcohólicas de forma esporádica o habitual parece estable; entre los estudiantes de 14 a 18 años la prevalencia de consumo de alcohol en los últimos 12 meses también se mantiene sin cambios: 74,9% en 2006, 72,9% en 2008 y 73,6% en 2010 y, sin embargo, desde 2006 se viene observando una marcada tendencia ascendente de las intoxicaciones agudas (borracheras) y el consumo intensivo. Así, la prevalencia mensual de borracheras (haber experimentado una en el mes previo) se ha incrementado, pasando de un 28,0% en 2004 a un 29,5% en 2008 y un 35,6% en 2010.
Los efectos sobre el sistema nervioso central del alcohol etílico (etanol) derivan de su interacción con los sistemas de neurotransmisión mediados por el ácido gamma-aminobutírico (GABA), glutamato, opioides endógenos, dopamina, serotonina, acetilcolina, noradrenalina y adenosina, bien directa o indirectamente. La toxicidad orgánica del alcohol no es menos compleja, afectando a casi todas las funciones corporales; en concreto, su consumo crónico está asociado a afecciones gastrointestinales, enfermedades cardiovasculares, pulmonares y musculo-esqueléticas, trastornos reproductivos, daño prenatal, carencias nutricionales, alteraciones hormonales, ciertos tipos de cáncer, alteraciones neurológicas y enfermedad psiquiátrica.
En el tratamiento del alcoholismo deben contemplarse dos situaciones: el tratamiento del síndrome de abstinencia y la prevención de la recaída.
La supresión de la utilización de alcohol en el sujeto dependiente (alcohólico crónico) desencadena unos síntomas que, en orden creciente de gravedad, consisten en: ansiedad, temblor fino (manos, labios, lengua), sudoración, taquicardia, hipertensión leve, náuseas, cefaleas, cambios de humor, convulsiones, midriasis, fiebre, disminución del nivel de conciencia, amnesia, desorientación espacial y temporal, alucinaciones auditivas, alucinaciones visuales microzoópsicas 1 , alucinaciones táctiles, agitación psicomotora e ideas delirantes (delirium tremens). En el tratamiento del síndrome de abstinencia las benzodiazepinas , y particularmente el diazepam, vienen siendo utilizadas desde hace años, administrándolas 4 veces al día durante 5 días. Otros fármacos útiles son el óxido nitroso , que induce analgesia psicotrópica; el clometiazol , derivado de la vitamina B 1 , que presenta acciones sedante, anticonvulsivante e hipnótica de corta duración; la tiaprida , antipsicótico atípico eficaz para el tratamiento de las náuseas, la sudoración y el insomnio; y el haloperidol , antipsicótico clásico (butirofenona) útil en pacientes que presenten alucinaciones y cuadros muy agitados con delirium tremens . También se han utilizado los betabloqueantes (propranolol) para disminuir el temblor, la sudoración y la taquicardia, el agonista α 2 adrenérgico clonidina y la vitaminoterapia (B1, B6 y B12), para prevenir el déficit de vitaminas del grupo B, asociado frecuentemente al alcoholismo.
El tratamiento de prevención de la recaída se den establecer una vez superado el síndrome de abstinencia; en él es imprescindible la realización de psicoterapia individual, familiar y grupal, siendo necesario realizar un seguimiento y una evaluación del cumplimiento terapéutico. En lo que se refiere al tratamiento farmacológico de la dependencia alcohólica se distinguen tres tipos básicos:
- Fármacos aversivos del alcohol o interdictores, entre los que se encuentran el disulfiramo y la carbimida cálcica, que, al inhibir la aldehído-deshidrogenasa, producen, tras la ingesta de etanol, una acumulación plasmática de acetaldehído, el cual da lugar a un síndrome (shock acetaldehídico o efecto antabús, en referencia a la denominación comercial del disulfiramo) caracterizado por vasodilatación cutánea con rubefacción facial, sudoración, sed, cefalea pulsátil intensa, disnea, náuseas, vómitos, debilidad, desasosiego, vértigo, visión borrosa y confusión mental. El empleo de estos interdictores da buenos resultados en adictos muy motivados.
- Los fármacos anti-craving inhiben la compulsión en la búsqueda del alcohol sin necesidad de producir efectos disfóricos. Se emplean antagonistas opioides, que disminuyen la liberación de dopamina, reducen la tasa de recidiva y aumenta el tiempo de abstinencia principalmente en pacientes con historia familiar de dependencia alcohólica y con intenso craving.
- Para disminuir la sintomatología de la abstinencia, en la actualidad se utiliza el acamprosato, que disminuye la hiperexcitabilidad neuronal al potenciar la acción del ácido gamma-aminobutírico (GABA) y antagonizar al ácido glutámico sobre los receptores NMDA (N-metil-D-aspartato). Se tolera bien, asociándose escasos efectos adversos, por lo que está indicado como terapia de mantenimiento de la abstinencia alcohólica junto a la psicoterapia. Es eficaz en adictos con niveles altos de ansiedad y en mujeres.
Otro fármacos que están siendo objeto de estudio son los que actúan sobre la transmisión serotonérgica central como, el ondansetrón, un antiemético antagonista de los receptores 5-HT3; el topiramato, un antiepiléptico potenciador de la transmisión gabaérgica y antagonista de los receptores AMPA (ácido α-amino-3-hidroxi-5-metil- 4-isoxazolpropiónico) de glutamato; y el baclofeno, un agente antiespástico, agonista de los receptores GABAB. Algunas evidencias preliminares sugieren la efectividad de otras estrategias farmacoterapéuticas, como el empleo de antagonistas del receptor cannabinoide CB1, de agonistas parciales colinérgicos y de antipsicóticos atípicos como el aripiprazol.
ACCIÓN Y MECANISMO
El nalmefeno es un modulador del sistema opioide endógeno, con efectos antagonistas sobre los receptores mu (µ) y delta (d), y con una actividad agonista parcial sobre los kappa (k). Como consecuencia de ello, el nalmefeno contrarresta los efectos reforzantes del consumo de alcohol sobre los circuitos neurológicos de recompensa, reduciendo dicho consumo, al modular las funciones del sistema cortico-mesolímbico cerebral. Ha sido autorizado para la reducción del consumo de alcohol en pacientes adultos con dependencia del alcohol que presentan un nivel de consumo de alcohol de alto riesgo (NCR), sin síntomas de abstinencia físicos y que no requieran una desintoxicación inmediata.
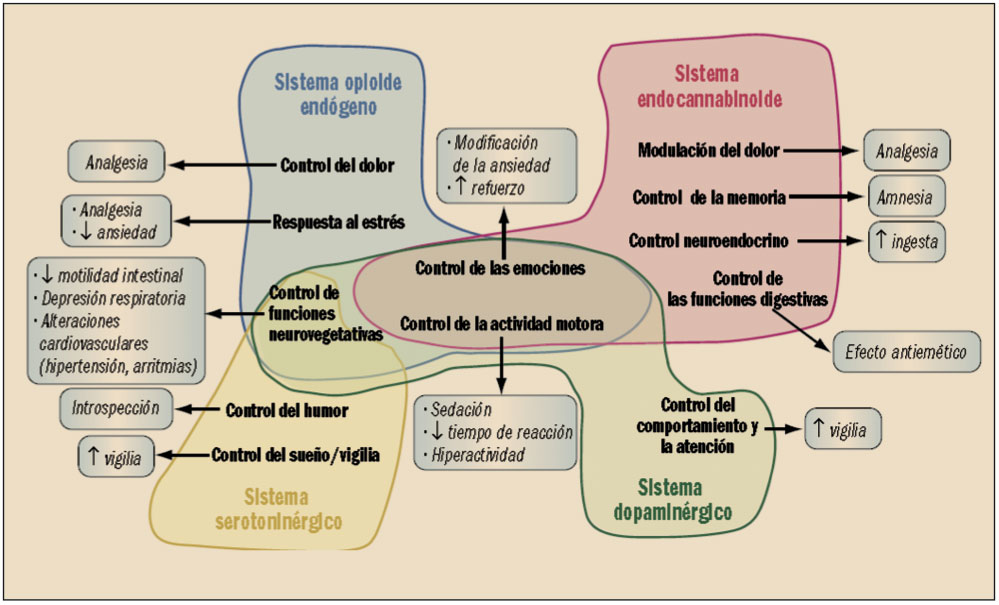
El consumo de alcohol provoca la liberación de dopamina en el sistema mesolímbico, lo que se considera un elemento fundamental para la activación de los denominados circuitos de recompensa, que generan sensaciones placenteras. Dicha liberación de dopamina está ligada a un complejo sistema interdependiente de tipo opioide (endorfinas), serotonérgico y endocannabinoide. En cualquier caso, el bloqueo de los receptores opioides, particularmente de los μ (mu) y δ (delta), se traduce en un reducción del efecto reforzante del alcohol sobre los circuitos de recompensa.
Se han descrito cuatro receptores opioides principales: el μ (mu), el δ (delta), el κ (kappa) y el "huérfano" u ORL1 (opioid receptor-like, subtipo 1), con varios subtipos: μ1 y μ2, δ1 y δ2, y κ1a, κ1b, κ2a y κ2b. Cuantitativamente, los receptores μ representan aproximadamente el 22% de todos los receptores opioides, mientras que los δ suponen el 35% y los κ el 42%; es decir, entre ellos agrupan al 99% de los receptores opioides existentes en el organismo. El receptor opioide μ (mu) está presente principalmente en neuronas de la médula espinal, el área gris periacueductal, el tálamo y la corteza cerebral. La activación de este receptor produce analgesia supraespinal, depresión respiratoria, euforia, sedación, reducción de la motilidad gastrointestinal, miosis y dependencia física. Por su parte, el receptor opioide δ (delta) se localiza fundamentalmente en el bulbo olfatorio, la corteza cerebral, el núcleo accumbens, la amígdala y el núcleo pontino. Su activación provoca analgesia supraespinal y (sobre todo) espinal, inhibición de la motilidad gastrointestinal y depresión respiratoria (aunque este efecto es controvertido). El receptor opioide κ (kappa) es más común en el sistema límbico, el hipotálamo, el área gris periacueductal y la médula espinal. Su activación se relaciona con analgesia espinal, sedación, disnea, dependencia, disforia e inhibición de la liberación de la hormona antidiurética (vasopresina, ADH).
Los antagonistas de receptores opioides se caracterizan por presentar una elevada afinidad por todos o la mayoría de los tipos de estos receptores, principalmente μ (mu) y δ (delta), pero producir ninguna actividad intrínseca. Por ello, son capaces de competir con los opioides endógenos (o los exógenos) y antagonizar sus efectos, por lo que son utilizados en casos de sobredosis de fármacos o de drogas opiáceas y en diferentes tratamientos de deshabituación.
ASPECTOS MOLECULARES
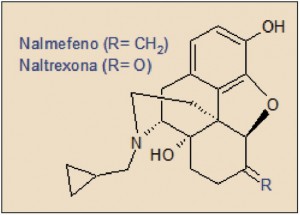
El nalmefeno está relacionado muy estrechamente con la naltrexona, de la que únicamente se diferencia por la sustitución del grupo carbonilo (C=O) de la naltrexona por un resto metilideno (C=CH2) en el nalmefeno. Guarda una notable analogía estructural con la morfina y otros opioides relacionados (codeína, oxicodona, etc.). Sin embargo, la sustitución del pequeño grupo metilo (–CH3) del átomo de N en estos últimos por grupos más voluminosos como el ciclopropilmetilo (-CH2(c)C3H7) de la naltrexona o del nalmefeno o como el alilo (-CH2CH=CH2) de la naloxona, determina el impedimento el efecto agonista sobre la mayoría de los receptores opioides, aun manteniendo una intensa afinidad por los mismos, convirtiéndose de hecho en bloqueantes y, en definitiva, en antagonistas al impedir la acción de los opioides endógenos sobre los correspondientes receptores (Cuéllar, 2012).
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas del nalmefeno en la indicación autorizada han sido documentadas fundamentalmente a través de dos ensayos clínicos de fase III (confirmatorios de eficacia y seguridad) con idéntico diseño, aleatorizados, doblemente ciegos y controlados con placebo. Fueron realizados en varios países europeos – incluida España – para tomar en consideración los diferentes hábitos sociales de consumo de bebidas alcohólicas.
Las personas incluidas en los estudios debían tener una media de al menos 6 días al mes con elevado nivel de consumo alcohólico (≥60 g/día para los varones y ≥40 g/día para las mujeres) y haber estados no más de 14 días consecutivos sin consumir alcohol (abstemios). El 80% de los sujetos tenían un consumo alcohólico calificado de riesgo alto o muy alto y un 20% de riesgo medio2, con una media basal de 20 días al mes de consumo elevado y 85-90 g/día de alcohol.
Los pacientes fueron aleatoriamente asignados a uno de los dos brazos de tratamiento de los estudios (un comprimido con 18 mg de nalmefeno o placebo), instruyéndoles para tomar un máximo de un comprimido al día cuando el propio paciente percibiese que estaba en riesgo de consumo elevado de alcohol, preferiblemente 1-2 horas antes del momento previsto de empezar a beber. El tratamiento se mantuvo durante 24 semanas (6 meses) en forma doblemente ciega; tras las que una parte del grupo tratado con nalmefeno siguió el tratamiento durante otras ocho semanas y la otra fue cambiada a placebo, mientras que los pacientes originalmente incluidos en el grupo placebo inicial se mantuvieron en el mismo hasta el final del estudio. Durante este periodo se hicieron 12 visitas de control a los pacientes registrándose los datos anotados por los pacientes en un diario con los datos requeridos. Todos los pacientes incluidos en los estudios tomaron parte de un programa psicosocial de motivación y potenciación de la adherencia (BRENDA).
Se utilizaron dos variables co-primarias de eficacia, consistentes en la variación entre el inicio y el final del estudio del número de días de consumo elevado de alcohol y del promedio de alcohol consumido diariamente, todo ello expresado en periodos mensuales.
El estudio ESENSE 1 (12014A; Mann, 2013) fue llevado a cabo sobre 604 pacientes, de los que finalizaron un 56% (46% del grupo del nalmefeno y 68% del placebo). En este estudio, el número medio de días de consumo elevado de alcohol fue reducido en el grupo del nalmefeno en una media 11,2 días vs. 8,9 en el del placebo, siendo la diferencia favorable al nalmefeno en 2,3 días al mes (IC95% -3,8 a -0,8; P= 0,0021), mientras que la variación del consumo medio diario supuso una reducción de 50,7 (nalmefeno) vs. 39,7 g/día (placebo), siendo la diferencia entre ambos de 11,0 g/día favorable al nalmefeno (IC95% -16,8 a -5,1; P< 0,001).
Por su parte, el estudio ESENSE 2 (12023A; Gual, 2013) incluyó a 718 pacientes, de los que finalizaron un 59% (57% del grupo del nalmefeno y 61% del placebo). Los resultados mostraron que el número medio de días de consumo elevado de alcohol fue reducido en 12,3 días con nalmefeno vs. 10,6 con placebo, siendo la diferencia favorable al nalmefeno en 1,7 días al mes (IC95% -3,1 a -0,4; P= 0,012), mientras que la variación del consumo medio diario supuso una reducción de 59,0 vs. 54,1 g/día, con una diferencia entre ambos de 5,0 g/día favorable al nalmefeno (IC95% -10,6 a 0,7; P= 0,088), estadísticamente no significativa.
Al hacer un análisis conjunto considerando exclusivamente los pacientes (N= 667) con niveles altos y muy altos de riesgo de consumo alcohólico (más de 60 g/día para varones y más de 40 para mujeres), la diferencia media en el número de días/mes de consumo elevado entre los pacientes con tratados con nalmefeno y los tratados con placebo fue de 3,2 días/mes a favor del nalmefeno (IC95% -4,8 a -1,6; p< 0,0001), siendo de 3,7 en el estudio ESENSE 1 y de 2,7 en el ESENSE 2; por su parte, la diferencia en el consumo diario medio de alcohol fue de 14,3 g favorable al nalmefeno (IC95% -20,8 a -7,8; P< 0,0001), siendo de 18,3 en el estudio ESENSE 1 y de 10,3 en el ESENSE 2 (van den Brink, 2013).
Complementariamente con los dos estudios anteriores, el estudio SENSE (12013A, EPAR) analizó la persistencia de la eficacia del tratamiento a lo largo de 52 semanas (un año) en 675 pacientes, de los que finalizaron el estudio un 63% (62% del grupo del nalmefeno y 68% del placebo), de los que un 52% presentaban un riesgo alto o muy alto de consumo alcohólico. Los resultados mostraron que la diferencia media en el número de días/mes de consumo elevado entre los pacientes con tratados con nalmefeno y los tratados con placebo fue de 5 días/mes a favor del nalmefeno (reducción de 19 a 5 días con nalmefeno y de 19 a 10 días con placebo), mientras que la diferencia en el consumo diario medio de alcohol fue de 22 g favorable al nalmefeno (reducción de 100 a 24 g/día con nalmefeno y de 101 a 47 con placebo).
Desde el punto de vista de la seguridad, la incidencia de eventos adversos que aparecieron durante el tratamiento en los ensayos clínicos controlados fue del 75% con nalmefeno y del 63% con placebo, siendo los más comunes (<10%) las náuseas, los mareos, el insomnio y la cefalea.
ASPECTOS INNOVADORES
El nalmefeno es un modulador del sistema opioide endógeno, con efectos antagonistas sobre los receptores µ y d, y agonista parcial sobre los k, contrarrestando los efectos reforzantes del consumo de alcohol sobre los circuitos neurológicos de recompensa, reduciendo dicho consumo, al modular las funciones del sistema cortico-mesolímbico cerebral. Ha sido autorizado para la reducción del consumo de alcohol en pacientes adultos con dependencia del alcohol que presentan un nivel de consumo de alcohol de alto riesgo, sin síntomas de abstinencia físicos y que no requieran una desintoxicación inmediata.
Los resultados de los estudios clínicos controlados con placebo muestran leves diferencias con el placebo, reduciendo respecto de éste entre 2,7 y 3,7 días de consumo elevado de alcohol cada mes, y entre 10 y 18 g/día de alcohol ingerido. Aunque esta diferencia es pequeña y, en algún caso, no alcanza la significación estadística, al hacer un análisis estratificado de los datos y considerando exclusivamente a los pacientes con riesgo alto o muy alto de consumo (más de 60 g/día para varones y más de 40 para mujeres), se aprecia en los pacientes tratados con nalmefeno una reducción de más del 50% en el número de días de consumo elevado de alcohol al mes (de 23 a 10-11 días/mes) y en la cantidad total de alcohol ingerida (de 102-113 a 43-44 g/día). Extrapolando estos resultados, supondría una reducción de 160 días adicionales por años sin consumo excesivo de alcohol. Esto supone que la eficacia del nalmefeno es claramente mejor entre los bebedores de alto o muy alto riesgo alcohólico.
Se echa claramente de menos la comparación con otros agentes empleados en la misma indicación y, desde luego, con la naltrexona. Otro aspecto importante a tener en cuenta es la alta tasa de abandono de los estudios controlados, que alcanzan el 43% de los asignados originalmente al nalmefeno y al 34% del grupo placebo, lo cual resta fiabilidad estadística a los resultados finales obtenidos. Además, se producido una posición divergente de varios miembros del CHMP (Committee of Human Medicinal Products) de la Agencia Europea de Medicamentos (EMA), que cuestionan la decisión final de autorización al considerar que la relevancia clínica del beneficio mostrado por el nalmefeno es escasa sobre el conjunto de la población y resultando el elevado número de pacientes que abandonaron los estudios controlados.
Desde el punto de vista de la seguridad, no parece haber problemas especialmente significativos, aunque un 10,5% de los pacientes tratados con nalmefeno abandonaron el tratamiento por no tolerar los eventos adversos (e incluso, esto esté infravalorado por la elevada tasa de pacientes que decidieron retirar su consentimiento). Los eventos adversos más comunes son náuseas, insomnio, mareos y cefalea, algunos de ellos indistinguibles de los síntomas asociados a la reducción del consumo de alcohol en personas muy dependientes de ellos. En cualquier caso, la mayoría de los eventos adversos son descritos al principio del tratamiento, mejorando la tolerabilidad a medida que éste progresaba. No parece que potencie los efectos adversos hepatotóxicos del alcohol.
Ciertamente, no parece que el nalmefeno mejore el tratamiento de la dependencia alcohólica, dominado fundamentalmente por acamprosato y naltrexona. Sin embargo, la forma de utilización a demanda puede calificarse como novedoso (Gual, 2014), ya que mejora las limitaciones de las pautas posológicas fijas. En este sentido, el nalmefeno fue tomado el 52% de los días y la tasa de cumplimiento adecuado del tratamiento (más del 80% de los días requeridos) fue del 68%; un aspecto a considerar para aquellos pacientes que tienen dificultades en seguir un tratamiento estricto
|
VALORACIÓN |
|
|---|---|
|
Nalmefeno ► SELINCRO® (Lundbeck) |
|
|
Grupo Terapéutico (ATC): N07BB. SISTEMA NERVIOSO. Fármacos usados en dependencia alcohólica. |
|
|
Indicaciones autorizadas: Reducción del consumo de alcohol en pacientes adultos con dependencia del alcohol que presentan un nivel de consumo de alcohol de alto riesgo (NCR), sin síntomas de abstinencia físicos y que no requieran una desintoxicación inmediata. |
|
|
VALORACIÓN GLOBAL: INNOVACIÓN MODERADA. Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar. |
♣♣ |
|
Novedad físico-química: Mejora las condiciones de uso. |
⇑ |
|
FÁRMACOS RELACIONADOS REGISTRADOS ANTERIORMENTE EN ESPAÑA |
|||
|---|---|---|---|
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Naltrexona |
Celupan |
Lácer |
1989 |
|
Nalmefeno |
Selincro |
Lindbeck |
2014 |
BIBLIOGRAFÍA
Bibliografía
- Alarcón de la Lastra Romero C. Terapéutica de otros trastornos del sistema nervioso. En: Terapéutica farmacológica de los trastornos del sistema nervioso. Programa de Actualización en Farmacología y Farmacoterapia. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2012. pp. 407-36.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S. Fármacos analgésicos. En: Terapéutica farmacológica de los trastornos del sistema nervioso. Programa de Actualización en Farmacología y Farmacoterapia. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2012. pp. 1-80.
-
European Medicines Agency. Selincro. European Public Assessment Report (EPAR). EMA/826403/2012; EMEA/H/C/002583. http://www.ema.europa.eu/docs/en_GB/document
_library/EPAR_-_Public_assessment_report/human/002583/WC500140326.pdf - Gual A, Bruguera P, López-Pelayo H. Nalmefene and its use in alcohol dependence. Drugs Today (Barc). 2014; 50(5): 347-55. doi: 10.1358/dot.2014.50.5.2132323.
- Gual A, He Y, Torup L, van den Brink W, Mann K; ESENSE 2 Study Group. A randomised, double-blind, placebo-controlled, efficacy study of nalmefene, as-needed use, in patients with alcohol dependence. Eur Neuropsychopharmacol. 2013; 23(11): 1432-42. doi: 10.1016/j.euroneuro.2013.02.006.
- Mann K, Bladström A, Torup L, Gual A, van den Brink W. Extending the treatment options in alcohol dependence: a randomized controlled study of as-needed nalmefene. Biol Psychiatry. 2013; 73(8): 706-13. doi: 10.1016/j.biopsych.2012.10.020.
- van den Brink W, Aubin HJ, Bladström A, Torup L, Gual A, Mann K. Efficacy of as-needed nalmefene in alcohol-dependent patients with at least a high drinking risk level: results from a subgroup analysis of two randomized controlled 6-month studies. Alcohol Alcohol. 2013; 48(5): 570-8. doi: 10.1093/alcalc/agt061.
1 Alucinaciones visuales que consisten en la visión de pequeños animales, generalmente insectos.
2 Se considera como riesgo muy alto aquellos con un nivel medio de consumo mayor de 100 g/día (varones) o de 60 g/día (mujeres); riesgo alto es 60-100 y 40-60 g/día, riesgo medio de 40-60 y 20-40 g/día y riesgo bajo con menos de 40 y 20 g/día.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares




