Ledipasvir/Sofosbuvir HARVONI® (Gilead)
 Nº383
Nº383
Resumen
La asociación de ledipasvir y de sofosbuvir es una combinación a dosis fijas (90 mg de ledipasvir y 400 mg de sofosbuvir, en un mismo comprimido) de dos antivirales de acción directa, ambos activos sobre los virus de la hepatitis C (VHC); actúan sobre dos pasos consecutivos del proceso final de replicación del ARN viral. El ledipasvir actúa inhibiendo específicamente la proteína NS5A, que participa en la replicación del genoma viral, en parte a través de interacciones con la ARN polimerasa dependiente del ARN viral (NS5B); por su parte, el sofosbuvir actúa inhibiendo selectivamente la proteína NS5B. Dicha combinación ha sido autorizada para el tratamiento de la hepatitis C en adultos. Los diversos ensayos clínicos realizados han demostrado una elevada eficacia (medida en términos de respuesta viral sostenida a las 12 semanas de finalizar el tratamiento) en pacientes con hepatitis crónica infectados con VHC de genotipo 1, en los que se han obtenidos tasas superiores al 97% en pacientes no pretratados (naïve), con o sin cirrosis compensada, con tratamientos de 12 semanas de duración y con independencia del uso de ribavirina. Incluso, en pacientes naïve sin cirrosis se han alcanzado tasas del 94% con 8 semanas de tratamiento vs. 95% con 12 semanas. En pacientes pretratados insatisfactoriamente, las tasas de respuesta viral sostenida son del 94% (12 semanas) y 99% (24 semanas). Considerados globalmente, en los pacientes con cirrosis compensada se obtienen también resultados excelentes (95% con 12 semanas y 98% con 24 semanas). También se han obtenido altas tasas de respuesta en pacientes coinfectados con VHC y VIH. La combinación presenta un perfil de seguridad muy benigno, con una óptima tolerabilidad de los pacientes y solo excepcionalmente es preciso suspender el tratamiento por este motivo (0,6%; 0,9% asociado a ribavirina). Los eventos adversos más frecuentes son astenia, cefalea, insomnio y náusea, casi siempre de intensidad leve.
HEPATITIS C
Se estima que la infección por el virus de la hepatitis C (VHC) afecta a 130-150 millones de personas en todo el mundo (1,8-2,0%), con una incidencia anual de 3-4 millones de nuevos casos. En España, la prevalencia de la infección por VHC C se sitúa en torno al 1,7% de la población general, lo que supone alrededor de 700.000 personas infectadas, la mayoría aún sin diagnosticar actualmente; de ellas, entre 400.000 y 600.000 desarrollarán hepatitis crónica. En cualquier caso, más del 50% de los pacientes que han necesitado un trasplante de hígado son pacientes con hepatitis C que han evolucionado a una enfermedad hepática terminal.
Existen numerosos genotipos y subgenotipos del VHC que, aunque no difieren en sus consecuencias clínicas fundamentales, sí implican respuestas diferentes a los fármacos antivirales. En España, el genotipo 1b supone 44% de los casos, frente al 26% del 1a, el 20% del 3, 8% del 4 y el 3% del 2.
Generalmente, la infección aguda por VHC es asintomática y muy raramente se asocia a una enfermedad mortal. Entre un 15% y un 45% de las personas inicialmente infectadas eliminan el virus espontáneamente en un plazo de tres a seis meses sin necesidad de tratamiento alguno, pero no parece haber casos de curación espontánea más allá del primer año tras la infección. El restante 55-85% desarrolla hepatitis crónica; de estos, un 70-85% se estabilizan mientras que el 15-30% restante evoluciona a cirrosis hepática a lo largo de un periodo muy variable, que oscila entre 5 y más de 30 años, de los cuales muchos acabarán por padecer un cáncer de hígado (hepatocarcinoma), a un ritmo de un 2% anual.
Tras la infección aguda y su distribución sanguínea, una vez en el hígado, el VHC utiliza la maquinaria celular del hepatocito para replicarse. La expresión del ARN viral conduce a la síntesis de una única proteína (poliproteína) de gran tamaño (3.011 aminoácidos), que requiere de la acción de varias proteasas para liberar las formas activas de las proteínas virales, que incluyen a tres proteínas estructurales (E) y siete no estructurales (NS). Esta poliproteína (C(F)-E1-E2-p7-NS2-NS3-NS4A-NS4B-NS5A-NS5B) genera al menos diez proteínas maduras al ser procesada por la señal peptidasa del retículo endoplásmico, liberando las proteínas C, E1, E2 y p7 que forman la cápside viral (C) y la envoltura de la partícula (E1 y E2); por su parte, la p7 forma los canales iónicos en la envoltura viral necesarios para la liberación del genoma.
Por su parte, la región de las proteínas no estructurales (NS2 a NS5B) que participan en la replicación son procesadas por dos enzimas virales: NS2 y NS3 que generan un corte autocatalítico en las regiones NS2-NS3 y NS3-NS4A respectivamente y permiten la formación del complejo serina-proteasa NS3/4A que procesa el resto de la poliproteína viral, provocando la maduración de las proteínas NS4B, NS5A y NS5B con función de polimerasa de ARN dependiente de ARN (NS5B) y de fosfoproteína (NS5A); por el momento, la función de la proteína NS4B no está plenamente comprendida. Estas proteínas NS toman el ARN viral formando un complejo de replicación – sistema replicón – que es asociado a membranas citoplasmáticas modificadas. En este sentido, la capacidad de replicación del VHC es enorme, calculándose en un billón (1012) el número de nuevos virus que son capaces de ser producidos durante un solo día en una persona infectada.
El tratamiento farmacológico de la hepatitis C crónica ha ido evolucionando de forma muy rápida en los últimos años. Hasta hace apenas cinco años en la administración de interferón alfa (generalmente, como peginterferón alfa) subcutáneo y ribavirina oral durante 24-72 semanas. Este tratamiento se asocia con una respuesta viral sostenida no demasiado satisfactoria (30-50%) y un perfil notable de efectos adversos.
En el año 2011 se produjo un cambio notable en el panorama terapéutico de la hepatitis C, al comercializarse el bocepreviry el telaprevir – la primera generación de inhibidores selectivos y reversibles de la proteasa NS3 – para el tratamiento de pacientes infectados por VHC de tipo 1, tanto no tratados previamente (naïve) como tratados, en combinación con peginterferón alfa y ribavirina (terapia triple). En estas circunstancias, las tasas de respuesta tanto en pacientes naïve como en pretratados llegaban a alcanzar hasta un 70% en algunas subpoblaciones de pacientes, permitiendo acortar la duración del tratamiento en algunos casos de 48 a 24 semanas. Sin embargo, boceprevir y telaprevir presentan un perfil toxicológico importante que obliga a suspender el tratamiento en un porcentaje de pacientes netamente superior a los tratados solo con peginterferón alfa y ribavirina, amén de un amplio abanico de interacciones farmacológicas, lo cual, asociado con la propia complejidad del tratamiento, dejaba un amplio margen para la mejora.
Tras esta primera generación de inhibidores de la proteasa del VHC, en 2014 llegó otra oleada de nuevos agentes con propiedades farmacodinámicas, farmacocinéticas y toxicológicas más satisfactorias que los anteriores, formada por el simeprevir, inhibidor dual de NS3 y NS4A, el daclatasvir, inhibidor de la NS5A, y el sofosbuvir, inhibidor de la NS5B (Cuéllar, 2015). Todos ellos presentan tasas de respuesta viral sostenida por encima del 80% para la mayoría de los genotipos y condiciones clínicas.
La forma de uso de todos ellos consiste en combinar dos o más para optimizar los resultados y, especialmente, reducir la duración de los tratamientos, excluir o reducir el uso de la terapia triple (peginterferón y ribavirina, más boceprevir o telaprevir), y reducir el riesgo de emergencia de cepas virales resistentes. Por este motivo, muchos de los nuevos medicamentos que están llegando actualmente consisten en combinaciones a dosis fijas de inhibidores de NS3/NS4A, NS5A y NS5B, con el objetivo adicional de optimizar la adherencia al tratamiento.
El criterio fundamental en la estrategia terapéutica es considerar el nivel de fibrosis hepática que presenta el paciente en el momento del diagnóstico, que determina la potencial utilidad de los tratamientos disponibles. Se suele cuantificar el nivel de fibrosis hepática mediante Fibroscan, considerándose como leve para niveles 0 y 1 (F0 y F1), moderada (F2), avanzada (F3) y grave (F4), típicamente cirrosis, que puede estar compensada o descompensada. La estrategia terapéutica definida actualmente en el Plan Estratégico para el abordaje de la hepatitis C en el Sistema Nacional de Salud (Rodés, 2015) propone tratar con los nuevos antivirales a pacientes tanto monoinfectados como coinfectados con el VIH:
- Pacientes con fibrosis hepática significativa (F2 a F4) con independencia de la existencia o no de complicaciones previas a la hepatopatía.
- Pacientes en lista de espera de trasplante hepático o trasplantados (hepáticos que hayan vuelto a infectarse y no hepáticos con hepatitis C).
- Pacientes que no hayan respondido a la triple terapia con inhibidores de la proteasa de primera generación.
- Pacientes con hepatitis C con manifestaciones extrahepáticas clínicamente relevantes del virus de la hepatitis C, sea cual sea el grado de fibrosis.
- En cualquier caso, y también con independencia del grado de fibrosis, se debe indicar el tratamiento en pacientes con elevado riesgo de trasmisión y mujeres en edad fértil que deseen un embarazo.
Según el genotipo, se han propuesto diferentes combinaciones de tratamientos considerando separadamente la condición de pacientes previamente no tratados (naïve) o con recaída tras un éxito inicial con terapia triple, con la de pacientes con fracaso previo a terapia triple. Entre las diversas opciones terapéuticas propuestas en la Estrategia ninguna tiene un carácter preferencial dado que no hay datos comparativos directos entre ellas.
ACCIÓN Y MECANISMO
La asociación de ledipasvir y de sofosbuvir es una combinación de dos antivirales de acción directa, ambos activos sobre los virus de la hepatitis C (VHC); actúan sobre dos pasos consecutivos del proceso final de replicación del ARN viral. Dicha combinación ha sido autorizada para el tratamiento de la hepatitis C en adultos.
El ledipasvir actúa inhibiendo específicamente la proteína NS5A, alterando su localización subcelular, sus procesos de hiperfosforilación e inhibiendo la síntesis de ARN viral. La proteína NS5A es una proteína intensamente fosforilada que, una vez escindida de la poliproteína viral, localiza a las membranas donde se une a la fracción 3’-terminal del ARN viral recién sintetizado y participa en la replicación del genoma viral, en parte a través de interacciones con la ARN polimerasa dependiente del ARN viral (NS5B).
El ledipasvir presente una elevada actividad frente al VHC, con valores de EC501 que oscilan entre 0,004 a 1,1 nM para los genotipos, 1a, 1b, 4a, 4d, 5a y 6a, siendo particularmente sensibles los genotipos 1a (EC50 0,01-0,03 nM) y 1b (0,004-0,007 nM). Los genotipos 2a, 2b, 3a y 6e presentan valores EC50 por encima de 15 nM. En los genotipos 1a y 1b se asocia la sensibilidad reducida al ledipasvir con la sustitución de un solo aminoácido Y93H2 (sustitución de tirosina por histidina en la posición 93 de la proteína NS5A). En el genotipo 1a, las mutaciones que se asocian con una pérdida más notable de sensibilidad (entre cien y más de mil veces) son la Q30H/R, L31I/M, P32L, Y93T, M28A/G, Q30E/G/K, H58D y Y93C/H/N/S; en el genotipo 1b son P58D, Y93S, A92K y Y93H.
Por su parte, el sofosbuvir actúa inhibiendo selectivamente la proteína NS5B, una ARN polimerasa dependiente del ARN viral, lo que impide la replicación del material genético viral. Dicha NS5B es responsable de producir la hebra de ARN complementaria – ARN(-) – que servirá de molde para fabricar las auténticas hebras de ARN viral – ARN(+) –, que a su vez podrán ser de nuevo replicados y traducidas, o bien empaquetados en las proteínas estructurales para formar nuevas partículas virales de VHC, que son liberadas mediante un proceso de exocitosis.
ASPECTOS MOLECULARES
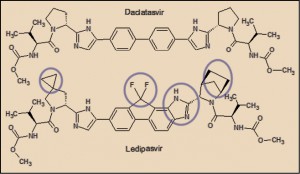
El ledipasvir presenta una notable similitud estructural con el daclatasvir, con el que comparte, además, mecanismo de acción (bloqueo de la NS5A). El ledipasvir presenta una estructura casi simétrica (como el daclatasvir), en la que destacan básicamente dos aspectos fundamentales. En primer lugar, el núcleo central de la molécula está formado por un grupo bifenilo condensado con un ciclopentano difluorado, ligado por sus dos extremos a sendos anillos imidazólicos (uno de ellos también condensado con el núcleo de bifenilo), formando un amplio sistema resonante, de alta densidad electrónica, el cual facilita la unión a la proteína NS5A, estabilizando su estructura y bloqueando sus funciones. En segundo lugar, se aprecian sendas estructuras en los extremos de la molécula que emulan secuencias peptídicas (en realidad, son carbamatos), que facilitan la inserción del fármaco en los huecos (bolsillos) de la proteína.
La proteína NS5A del VHC tiene 447 aminoácidos y su forma activa es como un homodímero que se organiza en tres ámbitos diferentes, de los cuales el dominio I es el más conservado y con una estructura más compleja. La NS5A puede existir en estado fosforilado o hiperfosforilado. Atendiendo a la gran similitud estructural ente el ledipasvir y el daclatasvir, es previsible que ambos tengan un comportamiento molecular idéntico. En este sentido, cabe recordar que el daclatasvir tiene un sitio de unión simétrico. Los anillos de bifenilo descansan en la parte superior de los dos grupos metilo del aminoácido T95 en los dos monómeros de la NS5A. Los anillos de los dos residuos Y93 extienden el canal hidrófobo para acomodar el resto del grupo bifenilo y uno de los anillos laterales del daclatasvir. Las cadenas de K26, I27 e I28 de las dos α-hélices y P97 de cada monómero completan las esquinas hidrófobas, permitiendo que el fármaco se ajuste fácilmente en la ranura hidrófoba formada en la esquina de los bolsillos de la proteína NS5A. Los restos R30 y Q54 forman cuatro enlaces de hidrógeno simétricos con daclatasvir (Barakat, 2015).
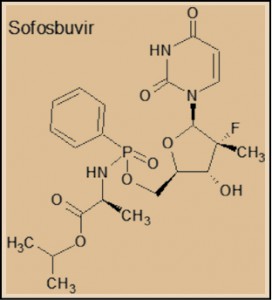
Por su parte, el sofosbuvir es un análogo estructural del uridilato (monofosfato de uridina, UMP), una de las cuatro bases nucleicas que constituyen el ARN; además, incluye un resto de L-alanina. Tras un proceso de fosforilación intracelular, el sofosbuvir es transformado en un derivado trifosfatado, que es la forma biológicamente activa del fármaco, actuando como un falso trifosfato de uridina (UTP) que es capaz de bloquear a la ARN polimerasa dependiente del ARN viral, provocando la finalización prematura del proceso de replicación y, con ello, deteniendo la reproducción del VHC.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad de la combinación ledipasvir/sofosbuvir en la indicación autorizada han sido contrastadas mediante tres ensayos clínicos principales de fase III, abiertos y aleatorizados, tanto en pacientes naïve (no tratados previamente) como en aquellos pretratados. En todos los casos, la variable primaria de eficacia utilizada fue la tasa de pacientes con respuesta virológica sostenida, es decir, aquellos con niveles séricos de menos de 25 copias/ml de ARN del VHC, medidos 12 semanas después de haber finalizado el tratamiento completo antiviral (RVS12). La pauta posológica empleada de la combinación fue de un comprimido oral al día, constituido por 90 mg h de ledipasvir y 400 mg de sofosbuvir, y de 500 o 600 mg/12 h (según peso) de ribabvirina.
En el estudio ION-3 (Kowdley, 2014) se incluyeron a un total de 647 pacientes con hepatitis C crónica infectados con el genotipo 1 de VHC que no hubiesen sido tratados previamente (naïve) y que no presentasen cirrosis, asignándoseles aleatoriamente a recibir uno de los siguientes tres tratamientos: ledipasvir/sofosbuvir durante 8 semanas, ledipasvir/sofosbuvir y ribavirina durante 8 semanas, o ledipasvir/sofosbuvir durante 12 semanas. Al final del estudio, las tasas de respuesta viral sostenida fueron del 94 % (IC95% 90 a 97) con ledipasvir/sofosbuvir 8 semanas; 94 % (IC95% 89 a 96) con ledipasvir/sofosbuvir más ribavirina 8 semanas y 95 % (IC95% 92 a 98) con ledipasvir/sofosbuvir 12 semanas. Es decir, en comparación con la tasa de respuesta viral sostenida de ledipasvir/sofosbuvir 8 semanas, la de 12 semanas solo supuso un incremento de un punto porcentual, estadísticamente no significativo (IC95% -4 a 6); asimismo, la ledipasvir/sofosbuvir más ribavirina 8 semanas, supuso una reducción de un punto porcentual, tampoco estadísticamente significativa (IC95% -6 a 4).
Por su parte, el estudio ION-1 (Afdhal, 2014a) se incluyeron a un total de 865 pacientes con hepatitis C crónica infectados con el genotipo 1 de VHC (67% con subgenotipo 1a) que no hubiesen sido tratados previamente (naïve); un 16% de los pacientes presentaba cirrosis. Se les asignó aleatoriamente uno de los siguientes tres tratamientos: ledipasvir/sofosbuvir durante 12 semanas, ledipasvir/sofosbuvir y ribavirina durante 12 semanas, o ledipasvir/sofosbuvir durante 24 semanas. Al final del estudio, las tasas de respuesta viral sostenida fueron del 99 % (IC95% 96 a 100) con ledipasvir/sofosbuvir 12 semanas; 97 % (IC95% 94 a 99) con ledipasvir/sofosbuvir más ribavirina 12 semanas y 98 % (IC95% 95 a 99) con ledipasvir/sofosbuvir 24 semanas.
En el estudio ION-2 (Afdhal, 2014b) se incluyeron a un total de 440 pacientes con hepatitis C crónica infectados con el genotipo 1 de VHC (79% con subgenotipo 1a) que hubiesen sido tratados previamente de forma insatisfactoria con ribavirina-peginterferón alfa (con o sin inhibidor de proteasa); un 20% de los pacientes presentaba cirrosis. Se les asignó aleatoriamente a recibir un tratamiento con ledipasvir/sofosbuvir durante 12 semanas, ledipasvir/sofosbuvir y ribavirina durante 12 semanas, o ledipasvir/sofosbuvir durante 24 semanas. Al final del estudio, las tasas de respuesta viral sostenida fueron del 94 % (IC95% 87 a 97) con ledipasvir/sofosbuvir 12 semanas; 96 % (IC95% 91 a 99) con ledipasvir/sofosbuvir más ribavirina 12 semanas y 99% (IC95% 95 a 100) con ledipasvir/sofosbuvir 24 semanas.
En un análisis post hoc de los datos procedentes de los tres estudios anteriores (Reddy, 2015) se estudió el efectos de las diferentes pautas posológicas sobre la respuesta viral sostenida en los 513 pacientes con cirrosis compensada; entre ellos, un 69% había recibido anteriormente tratamiento antiviral y un 47% había experimentado un fracaso terapéutico con inhibidores de proteasa (boceprevir o telaprevir). La tasa global de respuesta viral sostenida fue del 96% (IC95% 94 a 98), siendo del 98% entre los pacientes no tratados previamente y del 95% entre los pretratados insatisfactoriamente. Tampoco se observaron diferencias significativas en función de la duración del tratamiento o el uso (o no) conjunto con ribavirina; en este sentido, las tasas de respuesta fueron del 95% con 12 semanas y del 98% con 24 semanas de tratamiento ledipasvir/sofosbuvir; mientras que fueron del 97% y 95% con o sin adición de ribavirina, aunque los pacientes tratados previamente de forma insatisfactoria que recibieron ledipasvir/sofosbuvir sin ribavirina tuvieron unas tasas de respuesta viral sostenida del 90%.
Por último, en un estudio piloto de fase 2, abierto y realizado en un único centro (Osinusi, 2015), 50 pacientes con hepatitis C (genotipo 1) crónica sin cirrosis y sin haber sido previamente tratados con antivirales, pero co-infectados por VIH, fueron tratados con la combinación ledipasvir/sofosbuvir durante 12 semanas, obteniéndose una respuesta viral sostenida del 98 % (IC95% 89 a 100).
Desde el punto de vista de la seguridad clínica, los datos acumulados parecen sugerir un perfil toxicológico muy benigno para la combinación ledipasvir/sofosbuvir, lo que hace que la tolerabilidad de los pacientes sea óptima y solo excepcionalmente sea preciso suspender el tratamiento por este motivo (0,6%; 0,9% asociado a ribavirina). Aunque algunos de los eventos adversos asociados con el tratamiento pueden ser comunes, la intensidad de ellas es leve (incidencia del 1,0% de eventos adversos de grado 3 o superior) y perfectamente controlables con medidas sencillas: fatiga (38%; 0,3% de grado 3, 1,2% asociado a ribavirina), cefalea (26%; 0,6/0,6%), insomnio (18%; 0/0%) y náusea (17%; 0/0%).
ASPECTOS INNOVADORES
La asociación de ledipasvir y de sofosbuvir es una combinación a dosis fijas (90 mg de ledipasvir y 400 mg de sofosbuvir, en un mismo comprimido) de dos antivirales de acción directa, ambos activos sobre los virus de la hepatitis C (VHC); actúan sobre dos pasos consecutivos del proceso final de replicación del ARN viral. El ledipasvir actúa inhibiendo específicamente la proteína NS5A, participa en la replicación del genoma viral, en parte a través de interacciones con la ARN polimerasa dependiente del ARN viral (NS5B); por su parte, el sofosbuvir actúa inhibiendo selectivamente la proteína NS5B. Dicha combinación ha sido autorizada para el tratamiento de la hepatitis C en adultos.
Los diversos ensayos clínicos realizados han demostrado una elevada eficacia (medida en términos de respuesta viral sostenida a las 12 semanas de finalizar el tratamiento) en pacientes con hepatitis crónica infectados con VHC de genotipo 1, en los que se han obtenidos tasas superiores al 97% en pacientes no pretratados (naïve), con o sin cirrosis compensada, con tratamientos de 12 semanas de duración y con independencia del uso de ribavirina. Incluso, en pacientes naïve sin cirrosis se han alcanzado tasas del 94% con 8 semanas de tratamiento vs. 95% con 12 semanas. En pacientes pretratados insatisfactoriamente, las tasas de respuesta viral sostenida son del 94% (12 semanas) y 99% (24 semanas). Considerados globalmente, en los pacientes con cirrosis compensada se obtienen también resultados excelentes (95% con 12 semanas y 98% con 24 semanas). También se han obtenido altas tasas de respuesta en pacientes coinfectados con VHC y VIH.
La combinación presenta un perfil de seguridad muy benigno, con una óptima tolerabilidad de los pacientes y solo excepcionalmente es preciso suspender el tratamiento por este motivo (0,6%; 0,9% asociado a ribavirina). Los eventos adversos más frecuentes son astenia, cefalea, insomnio y náusea, casi siempre de intensidad leve.
Esta asociación a dosis fijas está indicada especialmente, en igualdad de condiciones con otros tratamientos en pacientes (no hay estudios clínicos directamente comparativos) en pacientes con hepatitis C crónica infectados con VHC de genotipo 1, tanto si han sido tratados previamente o no con terapia triple (peginterferón alfa, ribavirina y boceprevir o telaprevir). Su utilización en cuadros ligados a los genotipos 3 y 4 del VHC también es aceptable, aunque la experiencia clínica es mucho más limitada que para el genotipo 1. Asimismo, la asociación de ledipasvir y sofosbuvir está indicada en pacientes con VHC de genotipo 1, 3 y 4 con cirrosis, en aquellos con requerimiento de trasplante hepático y en los trasplantados hepáticos con recidiva.
La asociación de ledipasvir y sofosbuvir es la primera de las combinaciones a dosis fijas de inhibidores de NS5A y NS5B en ser comercializada, aunque hay otras combinaciones similares (incluyendo también a inhibidores de la NS3/NS4A), como la de la asociación de un medicamento combinado a dosis fijas (ombitasvir/paritaprevir/ritonavir) con otro medicamento independiente (dasabuvir). En principio, la justificación clínica de las combinaciones a dosis fijas es optimizar la adherencia al tratamiento, aunque en otros casos también se buscan efectos (interacciones entre los componentes) que optimicen el perfil farmacocinético de los fármacos.
La selección del mejor tratamiento en función del genotipo de VHC y de las condiciones clínicas de cada paciente (pretratamiento o no con antivirales de acción directa, cirrosis descompensada o no, trasplante hepático, etc.) se enfrenta a un conjunto de opciones, entre las que no es posible distinguir actualmente la más adecuada – en términos estrictamente clínicos y científicos – porque no se dispone de estudios clínicos directamente comparativos; pero, además, no lo es porque los niveles de eficacia y seguridad actualmente conseguidos son muy difíciles de superar. Un ejemplo de esto último es la combinación de daclatasvir (Daklinza®, también inhibidor de la NS5A, como el ledipasvir) y sofosbuvir. En pacientes con infección por VHC de genotipo 1a/1b insatisfactoriamente pretratados o no tratados previamente, la tasa global de respuesta a las 12 y a las 24 semanas fue del 98-100% (Sulkowski, 2014). Otro tanto puede decirse de la combinación entre simeprevir (Olysio®, inhibidor de la NS3/4A) y sofosbuvir, con tasas de respuesta del 92-94% en pacientes con hepatitis C crónica por VHC de genotipo 1 no pretratados o que previamente no habían respondido a peginterferón alfa y ribavirina (Lawitz, 2014).
Actualmente, más del 90% de los pacientes infectados con los genotipo 1 o 4 del VHC, con o sin cirrosis compensada o que hayan tenido un trasplante de hígado, pueden curarse mediante el uso de sofosbuvir combinado con simeprevir, daclatasvir o ledipasvir, o por la combinación de paritaprevir con ritonavir, ombitasvir y dasabuvir; incluso la adición de ribavirina parece acortar la duración del tratamiento. Sin embargo, la seguridad de estos fármacos no ha sido plenamente establecida en pacientes con cirrosis descompensada, por lo que no se aconseja el uso de los inhibidores de la proteasa en este grupo. Actualmente se está estudiando la utilización óptima de los regímenes sin interferón en pacientes con insuficiencia renal o después de un trasplante de riñón. Sin embargo, se necesitan nuevos y mejores medicamentos para el tratamiento de pacientes infectados con el genotipo 3 del VHC (Ferenci, 2015), lo que resulta relevante dado que en España el genotipo 3 está presente en el 20% de los casos de hepatitis C.
Por todo lo anterior, la combinación de ledipasvir y sofosbuvir no parece suponer una innovación significativa, aun teniendo en cuenta los elevadísimos niveles de eficacia y seguridad clínicas que presenta; en definitiva, se trata de una opción más a considerar en un ámbito donde existen ya varios fármacos que, asociados entre sí (aunque no sea en un mismo comprimido), presentan una eficacia y una seguridad similares, utilizando una misma vía y pauta posológica. Otra cosa diferente son los efectos económicos que cada uno de ellos produzca al competir en términos de coste de los tratamientos.
|
VALORACIÓN |
|
|
LEDIPASVIR/SOFOSBUVIR
|
|
|
Grupo Terapéutico (ATC): J05AE. ANTIINFECCIOSOS SISTÉMICOS. Antivirales de acción directa: inhibidores de la proteasa. |
|
|
Indicaciones autorizadas: Tratamiento de la hepatitis C crónica en adultos. |
|
|
VALORACIÓN GLOBAL: INNOVACIÓN MODERADA. Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar. |
♣♣ |
|
Novedad clínica: Mejora la eficacia clínica del tratamiento farmacológico estándar |
⇑ |
|
FÁRMACOS RELACIONADOS REGISTRADOS ANTERIORMENTE EN ESPAÑA |
|||
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Boceprevir |
Victrelis |
Merck Sharp Dohme |
2011 |
|
Telaprevir |
Incivo |
Janssen Cilag |
2011 |
|
Simeprevir |
Olysio |
Janssen Cilag |
2014 |
|
Sofosbuvir |
Sovaldi |
Gilead |
2014 |
|
Daclatasvir |
Daklinza |
Bristol-Myers Squibb |
2015 |
|
Ledipasvir/Sofosbuvir |
Harvoni |
Gilead |
2015 |
|
Ombitasvir/Paritaprevir/Ritonavir |
Viekirax |
Abbvie |
2015 |
|
Dasabuvir |
Exviera |
Abbvie |
2015 |
BIBLIOGRAFÍA
2 A: alanina (Ala); C: Cisteína (Cys); D: Ácido Aspártico (Asp); E: Ácido Glutámico (Glu); F: Fenilalanina (Phe); G: Glicina (Gly); H: Histidina (His); I: Isoleucina (Ile); K: Lisina (Lys); L: Leucina (Leu); M: Metionina (Met); N: Asparagina (Asn); Q: Glutamina (Gln); P: Prolina (Pro); R: Arginina (Arg); S: Serina (Ser); T: Treonina (Thr); V: Valina (Val); W: Triptófano (Trp); Y: Tirosina (Tyr).
Bibliografía
- Afdhal N, Zeuzem S, Kwo P, Chojkier M, Gitlin N, Puoti M, et al; ION-1 Investigators.Ledipasvir and sofosbuvir for untreated HCV genotype 1 infection. N Engl J Med. 2014; 370(20): 1889-98. doi: 10.1056/NEJMoa1402454.
- Afdhal N, Reddy KR, Nelson DR, Lawitz E, Gordon SC, Schiff E, et al; ION-2 Investigators.Ledipasvir and sofosbuvir for previously treated HCV genotype 1 infection. N Engl J Med. 2014; 370(16): 1483-93. doi: 10.1056/NEJMoa1316366.
- Agencia Española de Medicamentos y Productos Sanitarios. Informe de Posicionamiento Terapéutico de ledipasvir/sofosbuvir (Harvoni®); 20 de marzo de 2015. http://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-ledipasvir-sofosbuvir-harvoni.pdf
- Barakat KH, Anwar-Mohamed A, Tuszynski JA, Robins MJ, Tyrrell DL, Houghton M. A refined model of the HCV NS5A protein bound to daclatasvir explains drug-resistant mutations and activity against divergent genotypes. J Chem Inf Model. 2015; 55(2): 362-73. dx.doi.org/10.1021/ci400631n
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S.Terapéutica farmacológica de la hepatitis C. Panorama Actual Med. 2015; 39(381): 156-63.
- European Medicines Agency (EMA). Harvoni®.European Public Assessment Report (EPAR). EMA/702766/2014; EMEA/H/C/003850. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/003850/WC500177996.pdf
- Ferenci P).Treatment of hepatitis C in difficult-to-treat patients. Nat Rev Gastroenterol Hepatol. 2015 Apr 21. doi: 10.1038/nrgastro.2015.53.
- Kowdley KV, Gordon SC, Reddy KR, Rossaro L, Bernstein DE, Lawitz E, et al; ION-3 Investigators.Ledipasvir and sofosbuvir for 8 or 12 weeks for chronic HCV without cirrhosis. N Engl J Med. 2014; 370(20): 1879-88. doi: 10.1056/NEJMoa1402355.
- Lawitz E, Sulkowski MS, Ghalib R, Rodriguez-Torres M, Younossi ZM, Corregidor A, et al.Simeprevir plus sofosbuvir, with or without ribavirin, to treat chronic infection with hepatitis C virus genotype 1 in non-responders to pegylated interferon and ribavirin and treatment-naive patients: the COSMOS randomised study. Lancet. 2014; 384(9956):1756-65. doi: 10.1016/S0140-6736(14)61036-9.
- Osinusi A, Townsend K, Kohli A, Nelson A, Seamon C, Meissner EG, et al.Virologic response following combined ledipasvir and sofosbuvir administration in patients with HCV genotype 1 and HIV co-infection. JAMA. 2015; 313(12): 1232-9. doi: 10.1001/jama.2015.1373.
- Reddy KR, Bourlière M, Sulkowski M, Omata M, Zeuzem S, Feld JJ, et al.Ledipasvir and Sofosbuvir in Patients with Genotype 1 HCV and Compensated Cirrhosis: An Integrated Safety and Efficacy Analysis. Hepatology. 2015 Apr 4. doi: 10.1002/hep.27826.
- Rodés J, Albillos A, Andreu AL, Buti M, Crespo J, Moreno A, Zulaika D; Ministerio de Sanidad, Servicios Sociales e Igualdad. Plan Estratégico para el abordaje de la hepatitis C en el Sistema Nacional de Salud (2015).
- Sulkowski MS, Gardiner DF, Rodriguez-Torres M, Reddy KR, Hassanein T, et al; AI444040 Study Group.Daclatasvir plus sofosbuvir for previously treated or untreated chronic HCV infection. N Engl J Med. 2014; 370(3): 211-21. doi: 10.1056/NEJMoa1306218.
1 EC50% es la concentración efectiva para inhibir el 50% de los virus.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares