Idarucizumab ▼ Praxbind® (Boehringer Ingelheim) en la reversión de los efectos anticoagulantes del dabigatrán en situaciones de urgencia
 Nº395
Nº395
Resumen
El idarucizumab es un fragmento de anticuerpo monoclonal (Fab) humanizado que se une al dabigatrán con una elevada afinidad, formando un complejo estable que impide la acción anticoagulante del dabigatrán sobre la trombina. El medicamento ha sido autorizado para su uso en pacientes adultos tratados con dabigatrán cuando se necesita una reversión rápida de sus efectos anticoagulantes para intervenciones quirúrgicas de urgencia o procedimientos urgentes, o en el caso de hemorragias potencialmente mortales o no controladas. La incorporación del idarucizumab debe valorarse como una mejora de la seguridad de los pacientes anticoagulados con dabigatrán; sin embargo, no es la respuesta a todas las necesidades de estos pacientes, dado que un antídoto – por eficaz que sea – solo es una parte de las medidas que los pacientes requieren. Sea como fuere, a pesar de sus limitaciones, el idarucizumab constituye la única alternativa oficialmente autorizada para revertir específicamente el efecto anticoagulante del dabigatrán en las indicaciones señaladas.
ASPECTOS FISIOPATOLÓGICOS
Los llamados anticoagulantes de acción directa son aquellos cuyo mecanismo de acción consiste en un efecto inhibitorio directo sobre las proteasas más relevantes que forman parte de la cascada de coagulación, especialmente el Factor X (apixabán, rivaroxabán) y el Factor II (argatrobán, dabigatrán). Se trata de un conjunto de fármacos que constituyen una alternativa a los clásicos anticoagulantes cumarínicos, que actúan como anti-vitaminas K. La vitamina K (menadiona) es un factor esencial para el enzima gammaglutamil carboxilasa, responsable de incorporar grupos carboxilo a los restos de ácido glutámico presentes en los Factores II, VII, IX y X, proceso en el cual la propia vitamina K se oxida; para recuperar la forma reducida de la vitamina K entra en acción la vitamina K epóxido reductasa (VKORC), la cual es la diana farmacológica de los anticoagulantes cumarínicos (acenocumarol, warfarina), inhibiéndola y provocando con ello un déficit farmacológico de vitamina K y, en consecuencia, un efecto anticoagulante al afectar a varios puntos de la cascada de coagulación.
Los anticoagulantes cumarínicos o anti-vitaminas K han sido durante muchos años y siguen siendo ampliamente utilizados en clínica en numerosas indicaciones en las que se busca reducir la respuesta coagulante de la sangre, con el fin de reducir el riesgo de formación de trombos. Sin embargo, las cumarinas anti-vitaminas K (acenocumarol, warfarina) están asociadas a un importante riesgo de provocar hemorragias graves, eventualmente mortales. En este sentido, se estima que la tasa de hemorragias graves entre los usuarios crónicos de estos fármacos oscila entre un 1,5 y un 5,2% por año, con una tasa de mortalidad del 10% en estos episodios (Sié, 2016).
Debido al riesgo de hemorragias graves, la dosificación de los anticoagulantes cumarínicos se debe ajustar periódicamente en función del nivel de coagulabilidad sanguínea que presente cada paciente, utilizando como estándar internacional el INR (International Normalized Ratio), ajustando la dosificación periódicamente (generalmente, cada tres meses) de forma tal que el INR se mantenga entre 2 y 3, según la indicación y el tipo de paciente. Con todo y con ello, se ha citado (Chai-Adisaksopha, 2014) una incidencia del 4,6% de hemorragias graves, del 1,1% de hemorragias intracraneales y del 0,5% de hemorragias mortales. Por si fuera poco, el tratamiento con anti-vitaminas K está sujeto a otras necesidades y limitaciones, entre las que la inestabilidad de la respuesta anticoagulante no es la menor.
Frente a estas limitaciones, la incorporación en la última década de los inhibidores directos de la coagulación parece haber mejorado, al menos en parte, esta situación y sus efectos son más predecibles, producen menos interacciones y requieren un seguimiento clínico menos intenso. No obstante, los anticoagulantes cumarínicos aún se utilizan ampliamente porque tienen un panel de indicaciones terapéuticas aprobadas más amplio, permiten su uso en pacientes con insuficiencia renal grave y el ajuste posológico a través del INR es muy preciso.
Por otro lado, los anticoagulantes anti-vitamina K disponen de antídoto, como por ejemplo el concentrado de protrombina. Por el contrario, los inhibidores directos no tenían hasta ahora antídotos específicos, dado que tienen una semivida de eliminación relativamente corta (a diferencia de los cumarínicos) y sus riesgos hemorrágicos son, aparentemente, algo menores.
En la práctica clínica habitual, no obstante todo lo anterior, se dan una serie de circunstancias que hacen aconsejable e incluso necesaria la disponibilidad de antídotos que permitan revertir de forma rápida y segura la actividad anticoagulante de los inhibidores directos de la coagulación. Para empezar, los cuadros espontáneos de hemorragia grave pueden llegar a alcanzar una incidencia del 9% con dabigatrán en algunos grupos de pacientes (Hernández, 2015). Por otro lado, el riesgo de hemorragia está significativamente aumentado en el curso de intervenciones quirúrgicas u otro tipo de procesos de carácter invasivo, lo que obliga a interrumpir el tratamiento con dabigatrán al menos 24 horas (hasta cuatro días, en caso de pacientes con insuficiencia renal o con elevado riesgo de hemorragia). En caso de cirugía de urgencia, la incidencia de hemorragias graves alcanza hasta un 18% (Healey, 2012).
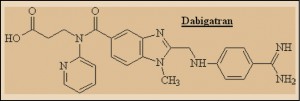
El dabigatrán es un agente antitrombótico de tipo no peptídico, que actúa como inhibidor directo, altamente selectivo, competitivo y reversible de la trombina (Factor II de la cascada de coagulación), el enzima que convierte el fibrinógeno en fibrina en la cascada de coagulación sanguínea; por lo tanto, la inhibición de la trombina previene el desarrollo de trombos. El fármaco inhibe tanto la trombina libre como la unida a fibrina y la agregación plaquetaria inducida por trombina. Como consecuencia de ello, el dabigatrán incrementa el tiempo de coagulación de una forma dependiente de la dosis y del tiempo.
El dabigatran es un peptidomimético1 inhibidor de la trombina, que emula parte de la estructura del fibrinógeno, específicamente la zona sobre la que actúa la trombina, facilitando la transformación en fibrina. La trombina es una serina proteasa de tipo tripsina formada mediante el fraccionamiento de la protrombina por el Factor Xa, otra serina proteasa. La trombina cataliza la conversión de fibrinógeno en fibrina, a través de la rotura del enlace peptídico entre los aminoácidos arginina (Arg) y glicina (Gly) dentro de la secuencia específica de Gly-Val-Arg-Gly-Pro-Arg.
El dabigatran (Pradaxa®) está oficialmente indicado en la prevención primaria de episodios tromboembólicos venosos en pacientes adultos sometidos a cirugía de reemplazo total de cadera o cirugía de reemplazo total de rodilla, programadas en ambos casos; asimismo, está indicado en la prevención del ictus y de la embolia sistémica en pacientes adultos con fibrilación auricular no valvular (FANV), con uno o más factores de riesgo tales como ictus o ataque isquémico transitorio (AIT) previos; edad ≥75años; insuficiencia cardíaca (≥Clase II escala NYHA); diabetes mellitus; hipertensión. Finalmente, también está indicado en el tratamiento de la trombosis venosa profunda (TVP) y de la embolia pulmonar (EP), y prevención de las recurrencias de la TVP y de la EP en adultos.
El fármaco es administrado por vía oral como etexilato de dabigatrán y tras su absorción digestiva – que es pequeña, con una biodisponibilidad inferior al 7% – es rápidamente transformado en la sangre en la forma activa, dabigatrán, por acción de las esterasas plasmáticas.
La incidencia de episodios hemorrágicos con dabigatrán en ensayos clínicos controlados no parece ser significativamente diferente de la asociada con enoxaparina; las tasas de pacientes con eventos hemorrágicos graves que requirieron la transfusión de más de 2 unidades de sangre son del 1,58% con la dosis de 220 mg de dabigatrán (D220) y del 0,75% con la de 150 mg (D150), frente a un 1,13% con dosis convencionales de enoxaparina (ENO), requiriéndose la suspensión del tratamiento debido a las hemorragias en el 0,16% de los tratados con D220 y en el 0,05% con D150 y ENO, mientras que hubo que reoperar debido a hemorragia en el 0,27% con D220 y 0,21% con D150 y EN (Cuéllar, 2008).
ACCIÓN Y MECANISMO
El idarucizumab es un fragmento de anticuerpo monoclonal (Fab) humanizado que se une al dabigatrán con una elevada afinidad, formando un complejo estable que impide la acción anticoagulante del dabigatrán sobre la trombina (Factor II). El medicamento ha sido autorizado para su uso en pacientes adultos tratados con dabigatrán cuando se necesita una reversión rápida de sus efectos anticoagulantes para intervenciones quirúrgicas de urgencia o procedimientos urgentes, o en el caso de hemorragias potencialmente mortales o no controladas.
El idarucizumab presenta una afinidad hacia el dabigatrán y sus metabolitos activos de 2,1 pM, lo que es 300 veces mayor que afinidad entre dabigatrán y la propia trombina. La formación de complejo idarucizumab-dabigatrán es muy rápida y, en cambio, es muy lentamente reversible (la semivida de separación del complejo es de 260 h). Esta elevada afinidad se mantiene incluso en un entorno químico ligeramente ácido (hasta con un pH de 6,7), lo que implica que el idarucizumab se une al dabigatrán incluso en condiciones de acidosis.
El dabigatrán se una a una zona del idarucizumab estructuralmente similar a la zona activa de la trombina. Sin embargo, el idarucizumab no se une a ningún otro sustrato trombínico, tal como los Factores V y XIII o la proteína C, entre otros, ni tampoco a la albúmina. El propio idarucizumab carece de actividad enzimática de tipo trombínico.
ASPECTOS MOLECULARES
Se trata de un fragmento molecular derivado de un anticuerpo monoclonal humanizado de origen murino de isotipo IgG1, formando por una cadena ligera (κ) y un fragmento de cadena pesada (γ). Ambas están unidas mediante un puente disulfuro (-S-S-) entre los restos de cisteína 225 del fragmento de la cadena pesada y el 219 de la cadena ligera; adicionalmente, ambas cadenas disponen cada una de ellas de otros cuatro puentes disulfuros intracatenarios. La molécula no está glucosilada.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas idarucizumab han sido adecuadamente contrastadas en las indicaciones autorizadas mediante varios ensayos clínicos de fase 1 (búsqueda de dosis, investigación de prueba de concepto) y uno de fase 3 (confirmatorios de eficacia y seguridad); este último aún está en fase de seguimiento.
Los estudios de fase 1 (Glund, 2015) incorporaron a voluntarios sanos que fueron pretratados con dabigatrán y que recibieron dosis diversas de idarucizumab (desde 1 a 8 g) o de placebo en infusión IV (5 min). Las características fisiológicas y demográficas de los voluntarios sanos pretratados con dabigatrán (187) que recibieron placebo (70) o idarucizumab (117) fuero: sexo masculino (73 vs. 84%), raza blanca (80 vs. 68%), 55 vs. 42 años de edad (mediana), de los que el 43 vs. 26% era mayores de 64 años, un 73 vs. 83% presentaban niveles normales de aclaramiento de creatinina, y presentan un peso medio de 73 vs. 83 kg y un índice de masa corporal de 24,9 vs. 23,7 kg/m2.
Los resultados mostraron que el 91-100% de los voluntarios sanos pretratados con dabigatrán revirtieron completamente el efecto anticoagulante dentro de las primeras cuatro horas tras la administración del idarucizumab con todas las dosis de éste (desde 1 a 8 g), determinado mediante varias pruebas de coagulación como el tiempo de trombina mediante plasma diluido (dTT), tiempo de coagulación de ecarina (ECT), tiempo de trombina (TT) o el TTPa (tiempo de tromboplastina parcial activada). En el caso de las dosis de 5 o más g de idarucizumab, los porcentajes de reversión completa del efecto anticoagulante fueron del 100% (dTT), 97-100% (ECT), 97-100% (TT) y 94-100% (TTPa). La reversión completa se consiguió al cabo de 5 a 6 minutos (mediana) tras la administración de todas las dosis de idarucizumab ensayadas; asimismo, la mediana de la duración de la reversión del efecto anticoagulante fue de 72 horas con las dosis de 2,5 g o mayores de idarucizumab utilizando todas las pruebas de coagulación, salvo en el caso del tiempo de trombina (TT) que fue de 16 h con dosis de 2,5 a menos de 5 g, de 24 h con la dosis de 5 g y de 72 h con dosis superiores (hasta 8 g). Un 8% del total de voluntarios que recibieron idarucizumab desarrollaron anticuerpos anti-idarucizumab, aunque con títulos bajos y mayoritariamente sin capacidad bloqueante.
El ensayo clínico de fase 3 (RE-VERSE AD; Pollack, 2015), todavía en curso, es un estudio prospectivo de cohorte, abierto, no controlado y multicéntrico, diseñado para incluir entre 200 y 300 pacientes tratados con idarucizumab en dos dosis de 2,5 g, separadas entre sí no más de 15 min. Los pacientes incluidos en este ensayo fueron agrupados en dos series; en la A se incluyó a pacientes que habían experimentado una hemorragia grave con dabigatrán, no susceptible de control con medidas convencionales, mientras que en la serie B se incluyó a pacientes que precisaban revertir el efecto anticoagulante del dabigatrán por requerir cirugía u otros procedimientos invasivos de urgencia.
El análisis intermedio de resultados se ha realizado cuando se contaba con 123 pacientes tratados, de los que se disponía de datos sobre eficacia para 90 de ellos (51 del grupo A y 39 del B). Las características demográficas y fisiopatológicas de estos eran: 53% varones, 77 años de edad (mediana), 72 kg de peso (mediana), aclaramiento de creatinina (mediana) de 55 ml/min (un 20% con ≥80), dosis diaria de dabigatrán de 110 (65%) o de 150 (20%) mg/12 h y habiendo transcurrido 15,6 h (mediana; ≥24 h para el 30%) desde la última dosis administrada de dabigatrán.
Como variable primaria de eficacia se determinó el porcentaje máximo de reversión del efecto anticoagulante, determinado entre la finalización del primer bolo IV de idarucizumab y hasta cuatro horas después del segundo, utilizando para ello determinaciones del tiempo de trombina mediante plasma diluido (dTT) y tiempo de coagulación de ecarina (ECT), aunque también se determinaron los valores del tiempo de trombina (TT) y del TTPa (tiempo de tromboplastina parcial activada). Dado que los valores de dTT eran normales en 22 de los pacientes al inicio del procedimiento, así como los de ECT en 9 de ellos, el porcentaje de reversión de la anticoagulación solo pudo ser determinado mediante dTT en 68 (40 del grupo A y 28 del B) y en 81 (47 del A y 343 del B) de los 90 pacientes considerados a efectos de eficacia.
Los resultados mostraron una tasa del 100% de reversión máxima en ambos grupos (IC95% 100 a 100) y con ambos parámetros (dTT y ECT), considerándose que el dTT se normalizó en el 98% y 93% de los grupos A y B, los de ECT en el 89% y 88%, respectivamente. A las 12 y a las 24 h, los valores de dTT estuvieron por debajo del límite superior de normalidad en el 90% y el 81%, respectivamente; en cuanto al ECT, los valores estuvieron por debajo del límite superior de normalidad en el 72% (12 h) y 54% (24 h).
La restauración de la hemostasia se produjo en el 91% (grupo A) y en el 92% (grupo B). El cese de la hemorragia entre los pacientes del grupo A se consiguió al cabo de 10 horas (mediana); por su parte, el 92% (33 de 36) de los pacientes del grupo B mostraron una hemostasia normal durante la intervención quirúrgica o el procedimiento invasivo.
Desde el punto de vista de la seguridad, de los 123 pacientes de los que se tienen datos procedentes del ensayo clínico de fase 3, se han registro un total de 26 muertes, 13 en cada uno de los grupos, atribuidos a hemorragias, posiblemente complicadas con comorbilidades presentes en los pacientes. Aunque se registraron eventos trombóticos en cinco de los pacientes, ninguno de ellos estaba en tratamiento antitrombótico cuando se produjeron, por lo que previsiblemente tales eventos tuvieron origen en la patología subyacente. En cuanto a los eventos adversos comunicados, los más comunes fueron hipopotasemia, delirio, estreñimiento y pirexia, todos ellos con un 7%; en un 6% se reportó neumonía.
ASPECTOS INNOVADORES
El idarucizumab es un fragmento de anticuerpo monoclonal (Fab) humanizado que se une al dabigatrán con una elevada afinidad, formando un complejo estable que impide la acción anticoagulante del dabigatrán sobre la trombina (Factor II). El medicamento ha sido autorizado para su uso en pacientes adultos tratados con dabigatrán cuando se necesita una reversión rápida de sus efectos anticoagulantes para intervenciones quirúrgicas de urgencia o procedimientos urgentes, o en el caso de hemorragias potencialmente mortales o no controladas.
Su eficacia y su seguridad han sido documentados mediante los resultados de varios estudios clínicos de fase 1 y un análisis intermedio de los datos acumulados de un ensayo de fase 3 que, no obstante, han sido considerados como suficientes – a la espera del final del estudio en marcha – para la autorización de comercialización del medicamento.
El efecto reversor del idarucizumab sobre el efecto anticoagulante del dabigatrán tarda apenas 5 o 6 minutos en manifestarse tras su administración y se mantiene duante al menos 72 horas, según los datos procedentes de los estudios realizados sobre voluntarios sanos. Los datos procedentes del estudio de fase 3 (RE-VERSE AD) han confirmado este nivel y rapidez de actividad reversora en prácticamente todos los pacientes, si bien ha podido constatarse que el beneficio clínico derivado de dicha reversión depende en gran manera de la situación patológica subyacente de cada paciente y de la gravedad de sus enfermedades y, en su caso, del cuadro hemorrágico. Aunque se han registrado 26 muertes relacionadas con cuadros hemorrágicos, sobre un total de 123 pacientes, posiblemente la mayoría se debe a complicaciones derivadas de las comorbilidades presentes en los pacientes; el resto de eventos adversos (hipopotasemia, delirio, estreñimiento, pirexia, etc.), generalmente de carácter leve o moderado, no superó el 10% de los pacientes y, posiblemente, no estén ni siquiera relacionados con el idarucizumab.
Actualmente, el tratamiento de la hemorragia inducida por dabigatrán o la reversión de su actividad antes de un procedimiento invasivo de emergencia ha sido objeto de numerosas aportaciones de expertos y de guías clínicas; todas ellas consideran que la administración de carbón activado es una de las primeras medidas, si la ingesta es reciente. Asimismo, el tratamiento de soporte es esencial, con una atención especial para mantener la perfusión renal y la producción de orina, debido a que el dabigatrán se elimina principalmente por vía renal. Dado que la semivida de eliminación del dabigatrán es relativamente corta (media de 14 horas), la mayoría de los episodios de hemorragia pueden ser manejdos mediante tratamiento convencional de soporte; incluso, si el paciente está hemodinámicamente estable, la hemodiálisis puede ser considerada en caso de sobredosis con dabigatrán. Por otro lado, actualmente se dispone de preparados con complejos de protrombina o de complejo coagulante antiinhibidor (Feiba®), que han demostrado in vitro su potencial en esta indicación; sin embargo, es cierto que la evidencia clínica de su utilidad en este caso es débil y, por otro lado, estos productos tienen un claro efecto protrombótico que tiene que ser cuidadosamente sopesado en función del estado clínico de cada paciente.
Qué duda cabe de que la incorporación de un antídoto específico en el ámbito de la anticoagulación es una noticia relevante; pero es preciso matizar este optimismo. Para empezar, debe considerarse que la disponibilidad de antídotos de los anticoagulantes de acción directa (inhibidores de los Factores II o X) podría relajar las medidas de precaución con que actualmente se manejan. En este sentido, debe recordarse que los anticoagulantes cumarínicos (acenocumarol, warfarina) también disponen de antídotos de acción rápida, como los mencionados complejos protrombínicos, pese a lo cual los cuadros hemorrágicos graves e incluso mortales todavía siguen siendo un problema relevante. Esto se debe fundamentalmente a dos cuestiones: la morbimortalidad asociada a las hemorragias se relaciona en buena parte con la patología subyacente de los pacientes y, en muchas ocasiones, la intervención correctora se realiza cuando la hemorragia ya ha producido daños irreversibles. En definitiva, incluso hasta el más perfecto antídoto solo constituye una parte de la solución al problema de la necesidad de reversión de la actividad anticoagulante (Sié, 2016).
Por todo ello, la incorporación del idarucizumab debe valorarse como una mejora de la seguridad de los pacientes anticoagulados con dabigatrán; sin embargo, no es la respuesta a todas las necesidades de estos pacientes, dado que, como ya se ha dicho, un antídoto – por eficaz que sea – solo es una parte de las medidas que los pacientes requieren: mejora (y, sobre, mayor celeridad) de los diagnósticos ambulatorios y hospitalarios, y desarrollo de protocolos de actuación sobre pacientes ingresados en urgencias con cuadros hemorrágicos severos. Sea como fuere, como reconoce el Informe de Posicionamiento Terapéutico (AEMPS, 2016), a pesar de sus limitaciones, el idarucizumab constituye la única alternativa oficialmente autorizada para revertir específicamente el efecto anticoagulante del dabigatrán en las indicaciones señaladas.
|
VALORACIÓN |
|
IDARUCIZUMAB
|
|
Grupo Terapéutico (ATC): V03AB. VARIOS. Todos los demás productos terapéuticos: antídotos. |
|
Indicaciones autorizadas: Pacientes adultos tratados con Pradaxa® (dabigatrán) cuando se necesita una reversión rápida de sus efectos anticoagulantes para intervenciones quirúrgicas de urgencia o procedimientos urgentes, o en el caso de hemorragias potencialmente mortales o no controladas. |
|
INNOVACIÓN importante. Aportación sustancial a la terapéutica estándar |
|
Novedad clínica: Mejora la eficacia clínica con relación al tratamiento estándar y supone la incorporación de una nueva vía terapéutica en ausencia de alternativas terapéuticas. |
BIBLIOGRAFÍA
Bibliografía
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de Posicionamiento Terapéutico de idarucizumab (Praxbind®) como antídoto específico para revertir el efecto anticoagulante de dabigatrán en situaciones de urgencia. http://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-idarucizumab-Praxbind-anticoagulantes-orales.pdf
- Chai-Adisaksopha C, Crowther M, Isayama T, Lim W. The impact of bleeding complications in patients receiving target-specific oral anticoagulants: a systematic review and meta-analysis. Blood. 2014; 124(15): 2450-8. doi: 10.1182/blood-2014-07-590323.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S. Dabigatran (Pradaxa®) en profilaxis de tromboembolismo venoso. Panorama Actual Med. 2008; 32(318): 1118-24.
- European Medicines Agency (EMA). Praxbind®. European Public Assessment Report (EPAR). EMA/634867/2015; EMEA/H/C/003986. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/003986/WC500197465.pdf
- Glund S, Stangier J, Schmohl M, Gansser D, Norris S, van Ryn J, et al. Safety, tolerability, and efficacy of idarucizumab for the reversal of the anticoagulant effect of dabigatran in healthy male volunteers: a randomised, placebo-controlled, double-blind phase 1 trial. Lancet. 2015; 386(9994): 680-90. doi: 10.1016/S0140-6736(15)60732-2.
- Glund S, Moschetti V, Norris S, Stangier J, Schmohl M, van Ryn J, et al. A randomised study in healthy volunteers to investigate the safety, tolerability and pharmacokinetics of idarucizumab, a specific antidote to dabigatran. Thromb Haemost. 2015; 113(5): 943-51. doi: 10.1160/TH14-12-1080.
- Healey JS, Eikelboom J, Douketis J, Wallentin L, Oldgren J, Yang S, et al; RE-LY Investigators. Periprocedural bleeding and thromboembolic events with dabigatran compared with warfarin: results from the Randomized Evaluation of Long-Term Anticoagulation Therapy (RE-LY) randomized trial. Circulation. 2012; 126(3): 343-8. doi: 10.1161/CIRCULATIONAHA.111.090464.
- Hernandez I, Baik SH, Piñera A, Zhang Y. Risk of bleeding with dabigatran in atrial fibrillation. JAMA Intern Med. 2015; 175(1): 18-24. doi: 10.1001/jamainternmed.2014.5398
- Pollack CV Jr, Reilly PA, Eikelboom J, Glund S, Verhamme P, Bernstein RA, et al. Idarucizumab for Dabigatran Reversal. N Engl J Med. 2015; 373(6): 511-20. doi: 10.1056/NEJMoa1502000.
- Sié P. Spotlight on idarucizumab and its potential for the reversal of anticoagulant effects of dabigatran. Drug Des Devel Ther. 2016; 10: 1683-9. doi: 10.2147/DDDT. S94167.
1 Se denominan agentes peptidomiméticos a aquellos productos que desarrollan un similar comportamiento sobre los receptores biológicos de determinados péptidos naturales, mimetizando sus efectos biológicos, con igual o mayor potencia en las actividad deseada, pero sin alguno o todos los problemas derivados de los efectos del péptido natural.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares





