Enzalutamida XTANDI® (Astellas)
 Nº379
Nº379
Resumen
Se estima que el cáncer de próstata representará en 2015 el 22% de todos los nuevos casos de cáncer diagnosticados en varones en España, siendo el tipo de cáncer más comúnmente diagnosticado en los varones, por delante del cáncer de pulmón y el de colon/recto. Al principio de su ciclo natural, el cáncer de próstata es dependiente de las hormonas androgénicas, pero al final de su evolución clínica deja de serlo y, por ello, se hace progresivamente resistente al tratamiento de privación androgénica. Sin embargo, es probable que contenga subpoblaciones de células dependientes de andrógenos incluso en las fases en las que el tumor es globalmente independiente de estas hormonas; por ello, la supresión androgénica continuada mantiene un valor relevante incluso en los varones con cáncer de próstata andrógeno-independiente.
La enzalutamida es un antagonista de los receptores androgénicos, indicado en el tratamiento de hombres adultos con cáncer de próstata metastásico resistente a la castración cuya enfermedad ha progresado durante o tras el tratamiento con docetaxel. Aunque la enzalutamida está estrechamente relacionada con otros antagonistas del receptor androgénico (flutamida, bicalutamida), la enzalutamida presenta algunas particularidades farmacológicas que tienen relevancia clínica. Los datos clínicos muestran una mejora de 4,8 meses en la supervivencia global con respecto al placebo, algo que es clínicamente relevante dada la condición prácticamente terminal de los pacientes con progresión tumoral tras recibir docetaxel. Por otro lado, el perfil de seguridad de la enzalutamida es aceptable. En definitiva, se trata de un nuevo fármaco del grupo de los antagonistas androgénicos, bioquímicamente evolucionado y clínicamente útil, que puede facilitar un moderado alargamiento de la supervivencia en pacientes con cuadros progresivos tras la terapia de segunda línea (con docetaxel) y, por tanto, se consolida como una alternativa a las opciones actualmente disponibles para estos pacientes: cabazitaxel y abiraterona, a utilizar en función del historial clínico y farmacoterapéutico de cada paciente.
CÁNCER DE PRÓSTATA
Se estima (IARC, 2014) que el cáncer de próstata representará en 2015 el 21,8% (29.602) de todos los nuevos casos de cáncer diagnosticados en varones en España (135.954), siendo el tipo de cáncer más comúnmente diagnosticado en los varones, por delante del cáncer de pulmón (23.119) y el de colon/recto (20.408). En cuanto a la mortalidad, el número de varones españoles que se estima que morirán en 2015 debido a un cáncer de próstata es de 5.743, lo que supone el 8,6% de todas las defunciones previstas por cáncer en varones en 2015 (67.129), por debajo del cáncer de pulmón (18.481; 27,5%) y del cáncer de colon (9.217; 13,7%). En Europa, el número de casos previstos de cáncer de próstata en 2015 es de 461.780, lo que representa un 22,2% de los 2.084.152 casos de cáncer en varones; por lo que respecta al número de muertes asociadas a este tipo de cáncer, la previsión para 2015 arroja valores de 107.566, un 9,5% del total de muertes por cáncer en varones (1.136.393).
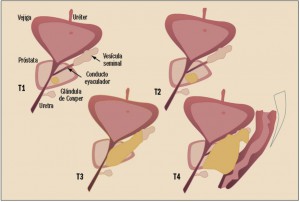
El cáncer de próstata generalmente es asintomático en los estadios iniciales, cuando el tumor se encuentra localizado en el interior de la próstata (T1 y T2), e incluso si ha invadido la cápsula o las vesículas seminales (T3). Los síntomas se relacionan con la presencia de metástasis en los huesos (dolor, fracturas, compresión medular) e invasión masiva de ganglios linfáticos (edemas de extremidades inferiores). En los tumores de gran tamaño, se pueden producir síntomas miccionales obstructivos o retención aguda de orina por la compresión uretral. Si el tumor invade la vejiga, se puede producir hematuria (sangre en la orina). También en los tumores avanzados o metastáticos se pueden observar síntomas generales como anorexia, pérdida de peso o caquexia (Cuéllar, 2013).
El sistema de estadificación tumoral más utilizado en cáncer de próstata es el índice de Gleason, el cual diferencia distintos patrones celulares (grupos mayoritarios) procedentes de varias muestras obtenidas en una biopsia de la próstata, cuantificándoles entre 1 (células normales) y 5 (células muy indiferenciadas). En el informe se utilizan dos números, representando el primero de ellos el patrón predominante y el segundo el patrón que le sigue en frecuencia (que puede tener el mismo índice que el primero, lo que significa que las muestras son muy homogéneas). El Gleason mínimo es 2 (1+1) y el máximo es 10 (5+5), siendo inusual que el Gleason primario y secundario difieran en más de una unidad. En un estudio (Johnson, 2013) llevado a cabo sobre más de 300 pacientes de Suecia, la sobrevida específica de la enfermedad para los pacientes con Gleason de 7 fue de 10 años; por el contrario, los pacientes con Gleason de 6 sobrevivieron 16 años, y aquellos con Gleason 4-5 sobrevivieron 20 años, por lo que parece claro que el pronóstico para los hombres que presentan tumores con un Gleason de 7 es peor que para hombres con tumores con Gleason 5 y 6. Sin embargo, está abierta la cuestión de si existen diferencias entre 3+4 y 4+3 para un mismo Gleason de 7; es decir, no está tan claro si existe diferencias cuando es el patrón primario o el secundario el que tiene una puntuación de Gleason 4.
Estadísticamente, 1 de cada 6 varones desarrollará en España un cáncer de próstata a lo largo de su vida. Esta probabilidad aumenta con la edad, ya que 9 de cada 10 casos se diagnostican en mayores de 65 años. Afortunadamente, de todos los varones diagnosticados de cáncer de próstata, el 97% se mantienen vivos a los 5 años del diagnóstico, cerca del 80% a los 10 años y el 60% a los 15 años, considerando todos los estadios del cáncer de próstata, aunque excluyendo a los que mueren por otras causas.
La edad media de diagnóstico de cáncer de próstata en España es de 69 años (Cózar, 2013), con un 57% que presentan un Gleason≤6. Más del 70% de todos los cánceres de próstata se diagnostican cuando aún están localizados o confinados dentro de la próstata, y al menos el 85% no se ha extendido a los tejidos de alrededor de la próstata ni a los ganglios linfáticos. Por este motivo, muchos de los pacientes recién diagnosticados probablemente acabarán muriendo por cualquier otra causa sin haber padecido jamás ninguna alteración significativa proveniente de su cáncer de próstata. Sólo un 6% de los hombres con cáncer de próstata presentan extensión a otras partes distantes del cuerpo en el momento del diagnóstico; entre estos la supervivencia al cabo de cinco años es del 34%, aunque dado que la tasa de crecimiento tumoral es muy variable, algunos pacientes con metástasis distales tienen una supervivencia mucho más prolongada.
Un 70% de los tumores prostáticos crecen en la zona periférica de la glándula, otro 15-20% en la zona central y el restante 10-15% en la zona transicional; la mayoría son multicéntricos. Más del 95% de los cánceres primarios de la próstata son adenocarcinomas (tumores glandulares). En general, el grado de diferenciación tumoral y la anormalidad del comportamiento histológico de crecimiento están directamente relacionados con la probabilidad de metástasis y de muerte. Otros factores que afectan el pronóstico de pacientes con cáncer de próstata incluyen el grado histológico del tumor, la edad del paciente, la coexistencia de otras enfermedades y la concentración sérica de antígeno prostático específico (PSA).
La etiología del cáncer de próstata no es bien conocida, aunque parece ser multifactorial, estando implicados la edad, la exposición a contaminantes ambientales (químicos, radiológicos, etc.), la raza, el estilo de vida, los antecedentes familiares de cáncer de próstata y factores genéticos, y los procesos inflamatorios crónicos en la próstata (adenoma prostático benigno). Recientemente, se ha relacionado la aparición de cáncer de próstata con el consumo de una dieta rica en grasas animales o carnes rojas, escasa actividad física y sexual, tabaquismo o consumo excesivo de alcohol. En general, cuando un familiar de primer grado padece un cáncer de próstata, se duplica el riesgo como mínimo; cuando dos o más familiares de primer grado se encuentran afectados, el riesgo aumenta entre 5 y 11 veces. Una pequeña subpoblación de pacientes (en torno al 9 %) presenta un auténtico cáncer de próstata hereditario, que se define como la existencia de tres o más familiares afectados o al menos dos familiares con enfermedad de comienzo precoz, es decir, antes de los 55 años. En los pacientes con cáncer de próstata hereditario éste suele tener un comienzo 6-7 años antes que los casos espontáneos, pero no difiere en otros sentidos.
El cáncer de próstata tiende a ser multifocal y con frecuencia afecta a la cápsula glandular. Al contrario que la hipertrofia benigna de próstata, el cáncer de próstata predomina en la periferia de la próstata. Ambas características (multifocal y periférica) hacen muy complicada y frecuentemente impracticable la resección transuretral del tumor, especialmente cuando se encuentra en una fase avanzada.
La biología del adenocarcinoma de próstata está fuertemente influida por el grado de diferenciación celular. Los tumores de bajo grado pueden permanecer localizados durante largos periodos de tiempo. La cápsula prostática es una frontera natural que se opone a la invasión de las estructuras vecinas por el tumor, pero éste se extiende directamente hacia arriba y penetra en las vesículas seminales y en suelo de la vejiga. La propagación linfática aparece por orden decreciente en los ganglios obturadores, ilíacos internos, ilíacos comunes, presacros y paraaórticos; es muy infrecuente que haya metástasis a distancia sin que estén afectados los ganglios linfáticos. El tejido óseo es el que con más frecuencia se ve afectado por las metástasis del cáncer de próstata, generalmente de carácter osteoblástico (producción de tejido óseo), aunque ocasionalmente pueden aparecer lesiones osteolíticas (que provocan microfracturas óseas y, en general, fragilidad ósea). Las metástasis en el hueso son, por orden de frecuencia, en pelvis > vértebras lumbares > vértebras dorsales > costillas. Las metástasis en las vísceras son menos frecuentes: pulmón > hígado > glándulas suprarrenales > cerebro.
El tipo de tratamiento depende de varios factores: estadio clínico, factores pronósticos y expectativa de vida del paciente. En general se opta por una terapia con intención curativa cuando la expectativa de vida es mayor de 10 años, incluyendo la cirugía (prostatectomía radical) y la radioterapia.
En los estadios iniciales de la enfermedad (estadios T1 y T2) en los que el tumor se considera localizado o de bajo riesgo, existe consenso en la realización de tratamiento con intención curativa, ya sea con cirugía radical, o con radioterapia externa o interna (esta última denominada braquiterapia), si la expectativa de vida del paciente es superior a 10 años. En varones muy ancianos o con expectativa de vida menor de 10 años, la actitud de esperar y ver – vigilancia expectante o activa, watchful waiting – es la opción terapéutica de referencia, especialmente cuando los tumores están bien diferenciados. También es una opción en los pacientes con tumores Gleason ≤6, al menos dos biopsias positivas y ≤50% de afectación por cáncer en cada biopsia, así como en pacientes con una expectativa de vida de menos de 10 años o que no acepten las posibles complicaciones relacionadas con otros tratamientos. En los pacientes con tumor localmente avanzado (estadio T3) y expectativa de vida mayor de 10 años, el tratamiento más aceptado es la radioterapia con tratamiento hormonal neoadyuvante (iniciado 6 meses antes) y adyuvante (hasta 3 años después de finalizar la radioterapia). El tratamiento hormonal también se puede plantear como alternativa en los pacientes con expectativa de vida inferior a 10 años.
La prostatectomía radical (PR) con intención curativa sólo está indicada en cuando exista una biopsia de vesículas seminales y estudio de extensión negativos, factores de buen pronóstico asociados y linfadenectomía iliobturatriz bilateral previa a la cirugía con biopsia intraoperatoria negativa. Tras la realización de una prostatectomía radical, la indicación de radioterapia adyuvante se establece en los casos de alto riesgo de recidiva local. En general, la prostatectomía radical está especialmente indicada en los pacientes con cáncer de próstata localizado de riesgo bajo e intermedio (T1a-T2b, Gleason de 2-7 y PSA ≤20) y una esperanza de vida >10 años; también lo está opcionalmente en pacientes seleccionados con cáncer prostático localizado de alto riesgo y bajo volumen (T3a, Gleason de 8-10 o PSA >20) e incluso en pacientes muy seleccionados con tumores localizados de muy alto riesgo (cT3b-T4 N0, o cualquier T N1) en el contexto de un tratamiento multimodal. En general, no se recomienda el tratamiento neoadyuvante a corto plazo (3 meses) con análogos de la GnRH en caso de enfermedad en estadio T1-T2 (Heindenreich, 2013).
La radioterapia externa postoperatoria inmediata tras una prostatectomía radical en pacientes con cáncer avanzado o de muy alto riesgo mejora la supervivencia global y la supervivencia libre de progresión tumoral. Por su parte, la braquiterapia (radioterapia interna) es un procedimiento consistente en la inserción de implantes radiactivos en la glándula prostática con el fin de destruir las células cancerosas. Estos implantes pueden ser emisores de alta o baja radiación. La técnica requiere la utilización de una sonda (habitualmente de ultrasonidos o una tomografía axial computadorizada, TAC) para visualizar la zona y la colocación del implante, que se coloca con agujas o aplicadores especiales a través del perineo. La braquiterapia produce buenos resultados y la mayoría de pacientes permanecen libres de cáncer prostático o lo mantienen bajo control durante muchos años. En general, la braquiterapia tiene menos complicaciones y efectos secundarios que la radioterapia externa, aunque entre las complicaciones descritas figuran impotencia sexual, dificultades miccionales, irritación cutánea en el recto o sangrado proveniente de éste y llagas o fístulas en el recto y estrechamiento de la uretra; aunque todos ellos son poco comunes, en caso de producirse pueden persistir hasta varios meses.
Es bien conocido que al principio de su ciclo natural el cáncer de próstata es dependiente de las hormonas androgénicas, pero al final de su evolución clínica deja de serlo y, por ello, se hace resistente al tratamiento de privación androgénica. Sin embargo, es probable que el cáncer de próstata contenga subpoblaciones de células dependientes de andrógenos incluso en las fases en las que el tumor es globalmente independiente de estas hormonas; por ello, la supresión androgénica continuada mantiene un valor relevante incluso en los varones con cáncer de próstata andrógeno-independiente.
En principio, es importante alcanzar concentraciones séricas de testosterona lo más bajas posible para que el tratamiento de privación androgénica logre reducir al mínimo la estimulación de las células cancerosas de la próstata. Las concentraciones séricas de testosterona que corresponden a los niveles de castración se han establecido en menos de 50 ng/dl (1,7 nmol/l). La consecución de valores de testosterona equivalentes a los de la castración es un criterio indirecto de valoración aceptable en el cáncer de próstata avanzado sensible a hormonas que puede asociarse a un descenso del dolor causado por las metástasis óseas, a una mejoría del flujo urinario y, en algunos casos, al retraso de la progresión del tumor, si bien no se ha demostrado una clara relación con la ampliación de la supervivencia. Por esto último, la privación androgénica se considera un tratamiento paliativo.
Antiguamente, para lograr la supresión de la testosterona se recurría a la orquiectomía bilateral (castración quirúrgica). Entre sus desventajas están los efectos psicológicos, la pérdida de la libido, la aparición de impotencia, de osteoporosis, de rubor y de sofocos. Actualmente sigue siendo un recurso, pero la terapia hormonal farmacológica permite obtener una auténtica castración química, sin las complicaciones que toda intervención quirúrgica plantea, además del propio rechazo psicológico por parte de algunos pacientes. Dicha castración química es conseguida mediante el uso, a veces combinado, de diversos agentes farmacológicos que impiden la síntesis o la actividad de las hormonas androgénicas, principalmente la testosterona y su principal metabolito intracitoplasmático, la dihidrotestosterona (DHT).
El 90-95% de toda la testosterona es producida por los testículos en los varones humanos y la mayor parte del restante 5-10% es producido en las glándulas suprarrenales. Pese a ello, la castración quirúrgica o la farmacológica tradicional (a base de superagonistas de GnRH) solo reduce la concentración de testosterona y de dihidrotestosterona (DHT) en un 70-80% en el interior de las células prostáticas. Esto es debido a la secreción por las glándulas suprarrenales de ciertas moléculas con propiedades débilmente androgénicas como la dihidroepiandrosterona (DHEA) y la androstenediona; de hecho, ésta se ha convertido en una diana farmacológica que ha permitido el desarrollo de los modernos inhibidores del citocromo CYP17, que anulan dicha vía. Con todo y con ello, en los pacientes con cáncer de próstata metastático, además hay una producción de testosterona por las propias células tumorales prostáticas y ello podría activar a las células tumorales hormonodependientes.
Se considera que al menos una tercera parte de los pacientes diagnosticados de cáncer de próstata recibirán un tratamiento hormonal en algún momento de su vida. Los beneficios aportados por el bloqueo androgénico en los pacientes con enfermedad avanzada son:
- Menos eventos urológicos (obstrucción uretral y/o ureteral, hematuria).
- Menos eventos óseos (microfracturas patológicas, dolor óseo, compresión medular).
- Menos metástasis extraesqueléticas.
En general, el tratamiento hormonal en el cáncer de próstata es inicialmente muy eficaz, con una mejoría sintomática en aproximadamente el 70-80% de los pacientes y una duración de la respuesta de dos años, pero todavía no está claro si se debe iniciar el tratamiento hormonal, es decir, si debe ser o no diferido hasta la aparición de síntomas o de progresión de la enfermedad, y la posibilidad de poder realizar un tratamiento hormonal intermitente frente a uno continuo, con una potencial mejoría en la calidad de vida por la disminución de la toxicidad derivada de los tratamientos.
En general, el bloqueo androgénico está indicado en las siguientes situaciones clínicas:
- Tumor localizado en pacientes ancianos o con expectativa de vida inferior a 10 años.
- Asociado a radioterapia en tumores localmente avanzados.
- Tumor metastásico.
- Como tratamiento de rescate tras recidiva bioquímica (elevación de PSA) después de la realización de tratamiento con intención curativa (cirugía radical o radioterapia).
En condiciones fisiológicas, la liberación pulsada cada 60-120 minutos de la hormona liberadora de gonadotropinas (gonadoliberina, gonadorrelina, Gonadotropin Release Hormone, GnRH) produce la secreción por la hipófisis anterior de hormona luteinizante (LH) y de hormona foliculoestimulante (FSH). La LH produce la secreción de testosterona a nivel testicular, mientras que la FSH activa la espermatogénesis. La GnRH es un decapéptido, en cuya estructura la sustitución de algunos aminoácidos produce cambios que prolongan su acción y aumentan su resistencia a la degradación enzimática, dando origen a los análogos sintéticos de GnRH. En los primeros días de su aplicación, los análogos producen un aumento de la secreción de LH y FSH por la hipófisis, de forma idéntica a como lo hace la propia GnRH natural, todo lo cual conlleva un incremento de la testosterona circulante. Sin embargo, estos análogos de GnRH o superagonistas del receptor de GnRH, producen un efecto permanente, por lo que a partir de los primeros 7 días de su administración (generalmente, mediante formas farmacéuticas de cesión continua) se produce un descenso mantenido de la LH y de la testosterona circulante; es decir, una castración química reversible. Los análogos de GnRH se administran habitualmente como implantes por vía subcutánea o como microesferas por vía intramuscular, de forma mensual, trimestral, semestral o incluso anual. Las respuestas obtenidas con los diferentes análogos de GnRH en pacientes con cáncer de próstata metastásico son superponibles, con respuestas objetivas que oscilan entre el 80% y el 93% de los casos, dependiendo de los meses de tratamiento. Tampoco se han observado diferencias en cuanto a las respuestas objetivas y la sobrevida entre los pacientes tratados con análogos de GnRH y los pacientes tratados con castración quirúrgica o con estrógenos.
Los antiandrógenos de acción directa bloquean competitivamente el receptor de andrógenos en el núcleo de las células prostáticas (tanto en las normales como en las tumorales). Según su estructura, se distinguen entre esteroídicos y no esteroídicos; tales diferencias estructurales tienen importantes implicaciones farmacológicas y toxicológicas. Entre los antiandrógenos esteroídicos se distinguen la ciproterona y el megestrol, aunque actualmente su uso clínico está limitado al tratamiento de los sofocos producidos por la supresión androgénica. Mucho más utilizados actualmente son los denominados antiandrógenos puros o no esteroídicos. La flutamida actúa bloqueando la unión de la dihidrotestosterona (DHT) con su receptor en la célula prostática. No se puede utilizar como monoterapia, sino que se debe asociar a análogos de GnRH, para contrarrestar el aumento en la liberación de LH, con el consiguiente aumento de la secreción de testosterona que finalmente competiría con la propia flutamida por el receptor y la desplazaría. Por su parte, la bicalutamida presenta un perfil farmacológico similar, aunque su afinidad hacia el receptor androgénico es el doble que la de la flutamida (pero 30 veces inferior que la de la DHT); hay datos clínicos contrastados que demuestran una mayor eficacia en términos de supervivencia, con menor toxicidad y menor tasa de suspensión del tratamiento.
La castración quirúrgica o el tratamiento con agonistas de la gonadorelina solo son eficaces en la reducción de la síntesis de andrógenos a nivel testicular, pero no afectan a otras rutas bioquímicas minoritarias de producción de andrógenos, como las glándulas suprarrenales o las propias células tumorales prostáticas. La abiraterona es un inhibidor de la biosíntesis de andrógenos a todos los niveles orgánicos, provocando una drástica reducción de los niveles de testosterona – hasta niveles indetectables en suero – cuando se administra a pacientes tratados con agonistas de la gonadorelina (GnRH) o castrados quirúrgicamente (orquiectomía bilateral). Ha sido autorizada para el tratamiento del cáncer de próstata metastásico resistente a la castración en hombres adultos que sean asintomáticos o levemente sintomáticos tras el fracaso del tratamiento de privación de andrógenos en los cuales la quimioterapia no está aun clínicamente indicada, así como para el tratamiento del cáncer de próstata metastásico resistente a la castración en hombres adultos cuya enfermedad ha progresado durante o tras un régimen de quimioterapia basado en docetaxel.
Específicamente, la abiraterona es un inhibidor irreversible y selectivo del enzima 17α-hidroxilasa/C17,20-liasa/17,20-desmolasa (conocido como citocromo P17 o CYP17), que impide la síntesis de todos los precursores biológicos de la testosterona, concretamente de la deshidroepiandrosterona (DHEA) y de la androstenodiona, lo que conduce a la práctica desaparición de la testosterona a nivel testicular, suprarrenal y prostático (incluyendo a las células tumorales productoras de testosterona) y, además, a un incremento colateral de la síntesis de mineralcorticoides en las suprarrenales. La abiraterona carece de efectos significativos sobre la aromatasa ni la 5α reductasa (Cuéllar, 2012).
En los pacientes con enfermedad metastásica, tres de cada cuatro casos tratados con hormonoterapia experimentan un descenso rápido de PSA hasta valores inferiores a 4 ng/mL. El valor más bajo (nadir) de PSA se suele alcanzar entre los 2,5 y los 4 meses, siendo los pacientes con enfermedad metastásica mínima los que experimentan un mayor porcentaje de respuesta en comparación con los que presenten un mayor número de metástasis (92% vs. 70%). No se han observado hasta el momento diferencias sustanciales que favorezcan el uso del bloqueo androgénico máximo frente a la castración quirúrgica u hormonal aislada. Tanto la orquiectomía como los análogos de la GnRH tienen similares resultados en lo referente a supervivencia de los pacientes y en lo referente al tiempo de permanencia libre de progresión de la enfermedad; en este sentido, varios meta-análisis han encontrado beneficios clínicos solo marginales en términos de supervivencia global para el bloqueo androgénico completo (2-3% a los 5 años). No parece tampoco haber diferencias significativas de resultados de distintos análogos de la LHRH entre sí.
Otra cuestión que está siendo objeto de debate es si el tratamiento hormonal se puede aplicar inmediatamente tras el diagnóstico de la enfermedad metastásica o diferirlo al momento en que aparezcan signos o síntomas de progresión tumoral. No obstante, los datos clínicos parecen apoyar la opción del tratamiento precoz, con mayores tasas de supervivencia y menos de probabilidades de progresar y morir por cáncer. También se ha planteado la opción de desarrollar la hormonoterapia del cáncer de próstata de forma intermitente frente al tratamiento continuo. El tratamiento intermitente consiste en un ciclo de inducción de 3 a 6 meses de análogos de GnRH y antiandrógenos. Si el PSA desciende, se suspende el tratamiento y los pacientes son controlados simplemente determinando los valores del PSA cada 3-6 meses. En el momento en el que el PSA ascienda por encima de 10 ng/ml se reinicia el tratamiento hormonal mediante bloqueo androgénico completo, durante otros 3-6 meses y se suspende nuevamente si el PSA desciende, y así sucesivamente hasta que no haya una respuesta satisfactoria. Aunque hay algunos estudios clínicos que no han encontrado diferencias en cuanto a la superviencia global, sí se ha observado una menor incidencia de efectos secundarios en los tratados de forma intermitente. Por otro lado, el coste del tratamiento es obviamente menor.
El papel de la quimioterapia en el cáncer de próstata era, hasta hace algún tiempo, muy cuestionado. Sin embargo, actualmente se acepta el uso de potentes agentes antineoplásicos en el cáncer metastático de próstata hormono-independiente, con el objetivo de disminuir el crecimiento del cáncer y reducir el dolor, obteniéndose respuestas parciales objetivas que alcanzan entre el 10 y el 40% de los casos.
El docetaxel es un análogo sintético del paclitaxel, cuyo efecto antitumoral se basa en la interrupción de la función de los microtúbulos en el mantenimiento de la morfología y la división celular. Además, los taxanos reducen la expresión de bcl-2, uno de los oncogenes que actúan bloqueando la apoptosis. También estimulan la síntesis de enzimas y factores de transcripción relacionados con la proliferación celular, la apoptosis y la inflamación. Cuando se usan con concentraciones menores de las que producen citotoxicidad, los taxanos actúan inhibiendo la angiogénesis. Además tiene un efecto radiosensibilizante al impedir la progresión del ciclo celular en G2, que es cuando la célula es más susceptible al daño inducido por las radiaciones ionizantes. En combinación con prednisona o prednisolona, el docetaxel está indicado para el tratamiento de pacientes con cáncer de próstata metastásico refractario a hormonas; de hecho, actualmente es considerado como el antineoplásico de referencia y de primera elección en esta indicación. El cabazitaxel también forma parte del grupo de los taxanos; ha sido autorizado para el tratamiento, en combinación con prednisona o prednisolona, de pacientes con cáncer de próstata metastático hormono-resistente, tratados anteriormente con una pauta terapéutica conteniendo docetaxel.
La mitoxantrona es empleada en combinación con corticosteroides, como quimioterapia inicial para el tratamiento de pacientes con dolor causado por cáncer de próstata avanzado resistente al tratamiento hormonal. Su papel en la quimioterapia del cáncer de próstata hormonorresistente ha ido perdiendo protagonismo a favor de los taxanos. Algo parecido ha ocurrido con el fluorouracilo.
El bevacizumab es un anticuerpo monoclonal que se une al factor de crecimiento del endotelio vascular (VEGF), factor clave de la angiogénesis tumoral, inhibiendo así la unión del VEFG a sus receptores Flt-1 (VEGFR-1) y KDR (VEGFR-2), situados en la superficie de las células endoteliales. La neutralización de la actividad biológica del VEGF produce una regresión de la vascularización de los tumores, normaliza la vasculatura residual del tumor e inhibe la neovascularización tumoral, inhibiendo así el crecimiento del tumor.
Finalmente, es preciso mencionar el desarrollo de ciertos tipos de vacunas, entre la que cabe destacar el Prostvac®, no disponible en España, que contiene transgenes de antígeno prostático específico (PSA) y de moléculas coestimuladoras de linfocitos T múltiples (TRICOM), que actúan sobre las células presentadoras de antígenos (APC), generando proteínas que son expresadas sobre la superficie de las APC en un contexto inmune. La interacción entre estas APC con los linfocitos T da lugar a una respuesta inmune antitumoral.
ACCIÓN Y MECANISMO
La enzalutamida es un antagonista de los receptores androgénicos, indicado en el tratamiento de hombres adultos con cáncer de próstata metastásico resistente a la castración cuya enfermedad ha progresado durante o tras el tratamiento con docetaxel. Al principio de su ciclo natural el cáncer de próstata es dependiente de las hormonas androgénicas, pero al final de su evolución clínica deja de serlo y, por ello, se hace progresivamente más resistente a la privación androgénica. Sin embargo, incluso en estos casos, los tumores cancerosos prostáticos suelen contener subpoblaciones de células dependientes de andrógenos incluso en las fases en las que el tumor es globalmente independiente de estas hormonas; por ello, la supresión androgénica continuada mantiene un valor relevante incluso en los varones con cáncer de próstata andrógeno-independiente.
ASPECTOS MOLECULARES
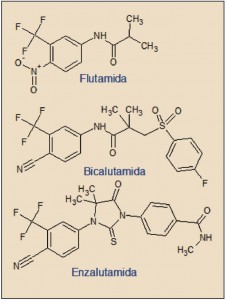
La enzalutamida está estrechamente relacionada química y farmacológicamente con otros antogonistas de los receptores androgénicos utilizados en el tratamiento del cáncer de próstata, tales como la flutamida y, en mayor medida, la bicalutamida. Sin embargo, la enzalutamida presenta una serie de características específicas que la diferencias de sus precursores farmacológicos, ya que carece de actividad agonista significativa, inhibe la inducción de PSA y actúa en múltiples pasos en la vía de señalización de los receptores androgénicos.
El fármaco impide competitivamente la unión de la testosterona al receptor androgénico y el cambio conformacional inducido por la unión de la testosterona al receptor. En este sentido, la enzalutamida tiene entre cinco a ocho veces mayor afinidad que la bicalutamida hacia el receptor androgénico. Asimismo, reduce la translocación nuclear del receptor androgénico activado, resultando en una disminución significativa de la cantidad de receptores presente en el citoplasma. Finalmente, el fármaco dificulta la unión del receptor activado con el ADN celular e interfiere con el reclutamiento del co-activador, todo lo cual resulta en una disminución del crecimiento celular y la producción de apoptosis celular y, en definitiva conduce a una reducción del volumen tumoral prostático.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas de la enzalutamida en la indicación autorizada han sido adecuadamente contrastadas mediante un ensayo clínico de fase III, multicéntrico, multinacional (Estados Unidos, Europa, Austrialia y Sudamérica), aleatorizado, doblemente ciego y controlado con placebo (AFFIRM, Scher, 2012), llevado a cabo sobre un total de 1.199 pacientes con adenocarcinoma de próstata histológica o citológicamente confirmado, de carácter progresivo (determinado por evolución de los valores de PSA o por imagen) y resistente a castración (quirúrgica o farmacológica), previamente tratados con docetaxel. Desde el punto de vista demográfico, la mediana de edad era de 69 años (41-92; un 23% tenía al menos 75 años), 93% de raza caucásica, 83 kg de mediana de peso, una media de PSA de 111,2 ng/ml, un 51% con un índice Gleason >7 (y un 47% con 5-7); el 91% presentaba metástasis óseas (más de una en el 87%) y un 23% metástatis pulmonares y/o hepáticas. Todos los pacientes recibieron por vía oral enzalutamida (160 mg/24 h) o el correspondiente placebo.
Como variables de eficacia, la primaria fue la supervivencia global (mediana del tiempo trascurrido entre el inicio del tratamiento y la muerte por cualquier causa); como variables secundarias se determinaron la mediana del tiempo hasta progresión del PSA (≥ 25% de incremento, con al menos un aumento de 2 ng/ml), supervivencia libre de progresión radiológica, tiempo hasta el primer evento esquelético y calidad de vida (porcentaje de pacientes que experimentan una mejor de al menos 10 puntos en el cuestionario FACT-P1).
El estudio fue detenido tras un análisis intermedio planificado, en el momento de contabilizar 520 muertes dentro de los pacientes incluidos inicialmente. El tratamiento fue mantenido en su extensión (hasta final del estudio o muerte del paciente) en el 21% de los pacientes inicialmente incorporados, habiéndolo suspendido el 62% por progresión de la enfermedad y otro 8,3% por eventos adversos asociados al tratamiento.
Los resultados mostraron de una mejora significativa de la supervivencia global en los pacientes tratados con enzalutamida vs. placebo de 18,4 vs. 13,6 meses, con una reducción del riesgo de muerte del 37% (Hazard ratio, HR= 0,631); por su parte, la mediana del tiempo hasta progresión del PSA fue de 8,3 vs. 3,0 meses (HR= 0,248), la supervivencia libre de progresión radiológica fue de 8,3 vs. 2,9 meses (HR= 0,404) y la mediana de tiempo hasta el primer evento esquelético fue de 16,7 vs. 13,3 meses (HR= 0,688). Los respectivos porcentajes de pacientes que experimentaron una reducción de al menos un 50% y un 90% en sus valores de PSA fueron del 54,0 vs. 1,5%, y 24,8 vs. 0,9%, respectivamente. Finalmente, el porcentaje de pacientes con experimentaron una mejora significativa de su calidad de vida fue del 43,2 vs. 18,3%. En todos los parámetros, las diferencias entre los grupos tratados con enzalutamida y placebo fueron estadísticamente significativas (p< 0,0001).
Desde el punto de vista de la seguridad, la mayor diferencia de la incidencia de los eventos adversos con enzalutamida con respecto al placebo fue del 20,3 vs. 10,3% (10,0 puntos porcentuales) para sofocos, 11,6 vs. 5,5% (5,9) para cefalea, 33,6 vs. 29,1% (4,5) para fatiga, 21,4 vs. 17,5% (3,9) para diarrea, 6,1 vs. 2,8% (3,3) para hipertensión, 14,5 vs. 11,5% (3,0) para dolor músculo-esquelético, 8,8 vs. 6,0% (2,8) para insomnio, 6,4 vs. 4,0% (2,4) para ansiedad, 15,3 vs. 13,3% (2,0) para edema periférico, 6,5 vs. 4,5% (2,0) para parestesia y 6,5 vs. 4,5% (2,0) para hematuria.
La incidencia de eventos adversos de grado 3 o superior fue del 46,5 vs. 53,1% (es decir, globalmente, más frecuentes con placebo), siendo más comunes con enzalutamida: fracturas óseas patológicas (1,5 vs. 0,5%), dolor de origen metastásico (1,5 vs. 0,8%) y compresión espinal (6,0 vs. 3,8%). La tasa de suspensión del tratamiento promovida por eventos adversos fue del 7,6 vs. 9,8% (más frecuente con placebo).
ASPECTOS INNOVADORES
La enzalutamida es un antagonista de los receptores androgénicos, indicado en el tratamiento de hombres adultos con cáncer de próstata metastásico resistente a la castración cuya enfermedad ha progresado durante o tras el tratamiento con docetaxel.
Aunque la enzalutamida está estrechamente relacionado con otros antagonistas del receptor androgénico (flutamida, bicalutamida), la enzalutamida tiene entre cinco a ocho veces mayor afinidad que la bicalutamida hacia el receptor androgénico. Pero, lo más importante es que además reduce la translocación nuclear del receptor androgénico activado, resultando en una disminución significativa de la cantidad de receptores presente en el citoplasma, y dificulta la unión del receptor activado con el ADN celular e interfiere con el reclutamiento del co-activador, todo lo cual resulta en una disminución del crecimiento celular y la producción de apoptosis celular y, en definitiva conduce a una reducción del volumen tumoral prostático. En este sentido, puede considerarse como una evolución farmacológica dentro de este grupo (Aragon-Ching, 2014).
Los datos procedentes del ensayo clínico pivotal (Scher, 2012) indican una clara superioridad del fármaco frente al placebo, con una mejora de 4,8 meses en la supervivencia global. Aunque pueda parecer un periodo no excesivamente grande, es clínicamente relevante dada la condición prácticamente terminal de los pacientes con progresión tumoral tras recibir docetaxel. El resto de variables clínicas, incluyendo calidad de vida, muestran una superioridad incontestable.
Por otro lado, el perfil de seguridad de la enzalutamida es aceptable, predominando los sofocos y las cefaleas como eventos más relevantes, si bien es preciso mencionar el registro de varios casos de crisis convulsivas, que son objetivo de la farmacovigilancia. En cualquier caso, la toxicidad no parece ser un elemento especialmente negativo para la enzalutamida.
Una vez que se produce la resistencia hormonal (incremento de la población de células tumorales independientes de la activación androgénica), no está claro si los regímenes posteriores con agentes antiandrogénicos ejercerían el mismo beneficio, ya que no existen comparaciones entre los medicamentos actualmente disponibles. Por lo tanto, queda mucho para los clínicos para determinar factores como la comorbilidad de los pacientes, el ritmo de progresión de la enfermedad, la presencia de metástasis predominantemente óseas o viscerales, síntomas, perfil de toxicidad, la preferencia del paciente, el costo y la accesibilidad, que permitan tomar decisiones adecuadas acerca de la elección de terapia (Patel, 2014). En este sentido, cabe indicar que hay pocos pacientes documentados en el estudio de referencia que recibiesen previamente abiraterona (0,5%). Algún estudio, en esta línea, ha informado sobre un efecto modesto de la enzalutamida en estos pacientes (Badrising, 2014). En cualquier caso, no está claro que la resistencia a la abiraterona presuponga la eficacia de la enzalutamida (Cassinello, 2014). Tampoco se dispone de datos clínicos comparable entre enzalutamida y cabazitaxel.
En definitiva, un nuevo fármaco del grupo de los antagonistas androgénicos, bioquímicamente evolucionado y clínicamente útil, que puede facilitar un moderado alargamiento de la supervivencia en pacientes con cuadros progresivos tras la terapia de segunda línea (con docetaxel) y, por tanto, se consolida como una alternativa a las opciones actualmente disponibles para estos pacientes: cabazitaxel y abiraterona, a utilizar en función del historial clínico y farmacoterapéutico de cada paciente.
|
VALORACIÓN |
|
|---|---|
|
Enzalutamida ► XTANDI® (Astellas) |
|
|
Grupo Terapéutico (ATC): L02BB. TERAPIA ANTINEOPLÁSICA Y AGENTES INMUNOMODULADORES. Terapia endocrina: antiandrógenos. |
|
|
Indicaciones autorizadas: Tratamiento de hombres adultos con cáncer de próstata metastásico resistente a la castración cuya enfermedad ha progresado durante o tras el tratamiento con docetaxel. |
|
|
VALORACIÓN GLOBAL: INNOVACIÓN MODERADA. Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar. |
♣ ♣ |
|
Novedad clínica: Mejora la eficacia clínica del tratamiento farmacológico estándar, siendo de utilidad en cuadros refractarios o inapropiados para los tratamientos actuales, y con posibilidad de asociar con otros tratamientos actualmente en vigor |
⇑ |
|
FÁRMACOS RELACIONADOS REGISTRADOS ANTERIORMENTE EN ESPAÑA* |
|||
|---|---|---|---|
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Flutamida |
Eulexin** |
MerckSharpDohme |
1987 |
|
Bicalutamida |
Casodex |
AstraZeneca |
1996 |
|
Enzalutamida |
Xtandi |
Astellas |
2014 |
* Se indican únicamente los primeros registros autorizados con ese principio activo.
** Actualmente, de baja.
BIBLIOGRAFÍA
Bibliografía
- Aragon-Ching JB. The evolution of prostate cancer therapy: targeting the androgen receptor. Front Oncol. 2014; 4: 295. doi: 10.3389/fonc.2014.00295.
- Badrising S, van der Noort V, van Oort IM, van den Berg HP, Los M, Hamberg P, Coenen JL, van den Eertwegh AJ, de Jong IJ, Kerver ED, van Tinteren H, Bergman AM. Clinical activity and tolerability of enzalutamide (MDV3100) in patients with metastatic, castration-resistant prostate cancer who progress after docetaxel and abiraterone treatment. Cancer. 2014; 120(7): 968-75. doi: 10.1002/cncr.28518.
- Cassinello J, Climent MA, González Del Alba A, Mellado B, Virizuela JA. SEOM Clinical guidelines for the treatment of metastatic prostate cancer. Clin Transl Oncol. 2014; 16(12): 1060-6. doi: 10.1007/s12094-014-1225-3.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cózar JM, Miñana B, Gómez-Veiga F, Rodríguez-Antolín A, Villavicencio H, Cantalapiedra A, Pedrosa, E. Registro nacional de cáncer de próstata 2010 en España. Actas Urol Esp. 2013; 37(1): 12-9.
- Cuéllar Rodríguez S. Cáncer de próstata. Panorama Actual Med. 2013; 37(365): 583-600.
- Cuéllar Rodríguez S. Abiraterona (Zytiga®). Panorama Actual Med. 2012; 36(351): 154-63.
- Elsada A, Pearce F, George E, Adler A. NICE guidance on enzalutamide for metastatic hormone-relapsed prostate cancer. Lancet Oncol. 2014; 15(10): 1058-9.
- European Medicines Agency (EMA). Xtandi®. European Public Assessment Report (EPAR). EMA/272506/2013; EMEA/H/C/002639. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002639/WC500144998.pdf
- Heidenreich A (chair), Bastian PJ, Bellmunt J, Bolla M, Joniau S, Mason MD, Matveev V, Mottet N, van der Kwast, Wiegel T, Zattoni F. Guidelines on prostate cancer. European Association of Urology 2013. http://www.uroweb.org/gls/pdf/09_Prostate_Cancer_LR.pdf
- International Agency for Research on Cancer (IARC). GLOBOCAN 2012: Estimated Cancer Incidence, Mortality and Prevalence in 2012; Prediction for 2015. http://globocan.iarc.fr/Pages/burden_sel.aspx
- Johnson D. Gleason 7: ¿una nueva categoría de riesgo? The ProstateNet. http://www.theprostatenet.org/espanol/gleason7.html
- Patel NK, Finianos A, Whitaker KD, Aragon-Ching JB. Advanced prostate cancer – patient survival and potential impact of enzalutamide and other emerging therapies. Ther Clin Risk Manag. 2014; 10: 651-64. doi: 10.2147/TCRM.S57509.
- Scher HI, Fizazi K, Saad F, Taplin ME, Sternberg CN, Miller K, de Wit R, Mulders P, Chi KN, Shore ND, Armstrong AJ, Flaig TW, Fléchon A, Mainwaring P, Fleming M, Hainsworth JD, Hirmand M, Selby B, Seely L, de Bono JS; AFFIRM Investigators. Increased survival with enzalutamide in prostate cancer after chemotherapy. N Engl J Med. 2012; 367(13): 1187-97.
1 Functional Assessment of Cancer Therapy (for patients with Prostate cancer). Se trata de un cuestionario formado por 39 preguntas sobre cinco aspectos relacionados con el bienestar del paciente: físico, social y familiar, emocional, funcional y otros aspectos adicionales. Cada cuestión puntúa de 0 a 4 y el resultado se suma.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares




