Edoxabán (▼Lixiana®, Daiichy Sankyo) en trombosis venosa profunda y embolia pulmonar, e ictus y embolia sistémica en pacientes con fibrilación auricular no valvular
 Nº396
Nº396
Resumen
El edoxabán es un agente antitrombótico autorizado para la prevención del ictus y de la embolia sistémica en pacientes adultos con fibrilación auricular no valvular con uno o más factores de riesgo tales como insuficiencia cardiaca congestiva, hipertensión, edad ≥75 años, diabetes mellitus, ictus o ataque isquémico transitorio; asimismo, está indicado en el tratamiento de la trombosis venosa profunda (TVP) y la embolia pulmonar (EB), y la prevención de las recurrencias de la TVP y la EP en adultos. Actúa inhibiendo de forma directa, competitiva, selectiva y reversible el Factor Xa, una serina proteasa que ocupa una posición crítica en el proceso de coagulación, catalizando la conversión de la protrombina (Factor II) en trombina (Factor IIa). El edoxabán está estructural y farmacológicamente relacionado con el apixabán y el rivaroxabán. Los datos clínicos indican que el edoxabán no es inferior a la warfarina en las dos indicaciones autorizadas, con algunas ventajas relativas a la menor incidencia de hemorragias intracraneales, pero mayor de las digestivas. En ambas indicaciones, el edoxabán mostró en general un menor riesgo de sangrado clínicamente relevante que la warfarina. Actualmente no existen pruebas definitivas para determinar qué inhibidor del factor Xa es más efectivo y más seguro para el tratamiento anticoagulante a largo plazo en pacientes con fibrilación auricular o en tromboembolismo venoso, debido a que aún no se realizaron estudios directos entre ellos. Sea como fuere, no hay datos que avalen que el edoxabán presenta un mejor perfil terapéutico o de seguridad que sus antecedentes farmacológicos, rivaroxabán y apixabán.
ASPECTOS FISIOPATOLÓGICOS
El termino hemostasia significa literalmente “detención de la sangre” y agrupa a todos los mecanismos fisiológicos que impiden la pérdida de sangre en el caso de rotura de un vaso sanguíneo: espasmo vascular, formación de un tapón de plaquetas, formación de un coágulo sanguíneo y proliferación final de tejido fibroso para el cierre completo de la lesión vascular, tal como queda plasmado en la figura 1.
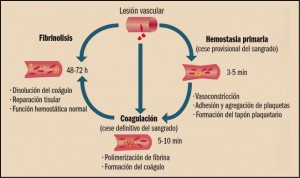
La coagulación es un proceso extremadamente complejo que incluye una serie de reacciones generadas en la superficie de las células, que expresan en su superficie el factor tisular (FT), y cuyo objetivo es la formación de trombina en sitios de lesión vascular. La denominada de cascada de la coagulación considera un proceso de 3 fases: inicio, amplificación y acción de la trombina. La fase de inicio se produce tras la lesión vascular, cuando el factor VII (proconvertina) se une a las células que presentan en su superficie el factor tisular de tromboplastina (factor III), lo que conduce a la liberación proteolítica de la convertina (VIIa). El complejo FT-VIIa facilita la generación de los factores Xa y IXa y esto causa la producción de una pequeña cantidad de trombina que inicia el proceso. La fase de amplificación se centra en la superficie de las plaquetas, activadas por la trombina, que acumulan en su superficie factores y cofactores y permiten su ensamblaje, dando lugar a complejos con actividad enzimática, como tenasa o protrombinasa, que facilitaran la fase de propagación, con la formación de grandes cantidades de trombina que favorecen la generación de fibrina y su polimerización, para dar lugar al coagulo estable (Benedí, 2012), según se indica en la figura 2.
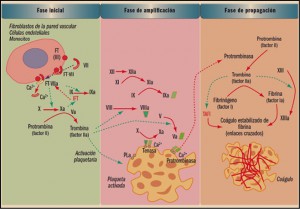
La trombosis es un proceso clínico en el que los mecanismos de la hemostasia se ponen en marcha ante estímulos de carácter no fisiológico, es decir, con una finalidad no reparadora, produciendo la obstrucción de un vaso sanguíneo mediante un coágulo. En estos casos, estímulos como una placa de ateroma, una alteración endotelial, un exceso de lípidos en sangre, etc., activan el funcionalismo plaquetario o el sistema plasmático de la coagulación, de forma que se inicia todo el proceso hemostático, pero dentro del torrente circulatorio. Asimismo, en otros casos, ciertas patologías producen una disminución de los mecanismos antitrombóticos endógenos, por lo que la balanza hemostática se inclina hacia el platillo de la trombosis.
En la trombosis venosa el trombo se forma en los vasos venosos, generalmente en la red profunda de las extremidades inferiores (trombosis venosa profunda, TVP), causada por mecanismos relacionados con el estancamiento sanguíneo – estasis – o con discrasias en la fase plasmática de la coagulación, tales como hepatopatías, efectos adversos de medicamentos – como los anticonceptivos hormonales –, etc. El primer elemento afectado de la hemostasia es la coagulación plasmática, siendo ésta la que secundariamente afecta a las plaquetas. Son trombos de escasa fijación a la pared venosa, de ahí que la principal consecuencia sea su embolización hacia otro territorio venoso que, generalmente, es el árbol venoso pulmonar, provocando con ello un embolismo o embolia pulmonar (EP).
La causa más frecuente de TVP en un medio hospitalario es la cirugía, considerándose a la de tipo general (digestiva, cirugía menor, etc.) de bajo riesgo (10% de incidencia de TVP y 0,1% de embolia pulmonar, en ausencia de medidas preventivas), mientras que la ortopédico-traumatológica, la oncológica, la cerebral y todas aquellas que conduzca a una larga estancia hospitalaria, son valoradas como de alto riesgo (40-70% de TVP y 10% de EP). En estas formas de cirugía, la causa del mayor riesgo está en un aglomerado de motivos, entre los que cabe citar la propia complejidad de la técnica quirúrgica, la afectación anatómica de múltiples vasos, la necesidad de inmovilidad prolongada, etc. Todo ello determina la necesidad de llevar a cabo una estricta prevención antitrombótica, tanto por medios farmacológicos como mediante procedimientos de manejo de los pacientes (movilización, ejercicio físico controlado, etc.). No en balde, la trombosis venosa profunda constituye la tercera causa de mortalidad cardiovascular, tras el infarto de miocardio y los accidentes cerebrovasculares.
Otra de las causas que pueden alterar patológicamente el procesos de hemostasia es la fibrilación auricular, una forma de arritmia cardiaca que ocurre cuando las aurículas fibrilan o “tiemblan”, debido a una elevada e irregular frecuencia de latidos (más de 300 por minuto, frente a los 60-100 fisiológicos en reposo). Aunque no se la suele considerar en sí misma como peligrosa, si persiste y no recibe un tratamiento adecuado, las complicaciones orgánicas pueden llegar a ser mortales, ya que la fibrilación de las aurículas provoca una reducción de la cantidad efectiva de sangre bombeada hacia los ventrículos, lo cual aumenta el riesgo de desarrollar un coágulo sanguíneo que, en el caso de desprenderse podría circular por el torrente sanguíneo. Una vez en éste, podría alcanzar un punto en que obturase un vaso (embolización), provocando un accidente cerebrovascular (el 15% de estos tienen su origen en una fibrilación auricular no tratada) o un infarto de miocardio, entre otros posibles cuadros de origen trombótico. De hecho, se estima que la fibrilación auricular incrementa entre 4 y 5 veces el riesgo de accidente cerebrovascular isquémico y de eventos embólicos sistémicos (Camm, 2010). Por otro lado, sin tratamiento, la fibrilación auricular también puede acabar provocando una taquicardia ventricular, lo que debilitaría gradualmente la pared de los ventrículos (cardiomiopatía), llegando, con el tiempo, a una insuficiencia cardiaca (January, 2014).
La fibrilación auricular es uno de los tipos más comunes de arritmia cardiaca. En España, la prevalencia de fibrilación auricular es elevada (4,4%) en la población general mayor de 40 años, similar en varones y mujeres, incrementándose sensiblemente y de forma escalonada a partir de los 60 años. Se estima en más de 1 millón de pacientes con fibrilación auricular en la población española, de los que más de 90.000 están sin diagnosticar (Gómez Doblas, 2014).
Existe un amplio y diverso grupo de fármacos susceptibles de interrumpir un proceso patológico de coagulación, con el fin último de impedir la formación o la acción de la trombina, susceptible de activar (transformar) el fibrinógeno en fibrina; es decir, evitar la progresión de un trombo en formación o el desarrollo de otros nuevos.
Más allá de los fármacos antiagregantes plaquetarios, que afectan a las fases preliminares de la coagulación pero que son incapaces de actuar una vez iniciada, y de los agentes fibrinolíticos, que únicamente actúan rompiendo la red de fibrina de los trombos ya formados, pero que no pueden prevenir la formación de otros nuevos, los anticoagulantes son los fármacos de referencia del grupo (figura 3).
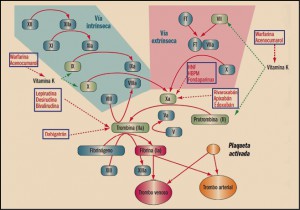
Durante más de seis décadas, los único anticoagulantes disponibles en clínica fueron los antagonistas de vitamina K (cumarinas: acenocumarol, warfarina). Posteriormente, el arsenal anticoagulante se ha ido ampliando y diversificando hasta llegar a la situación actual, en la que podemos encontrar los siguientes tipos:
- Inhibidores indirectos. Mediante su interacción con otras proteínas o actuando en otras vías metabólicas (a través de la antitrombina o del cofactor de heparina II), alteran el funcionamiento de la cascada de la coagulación:
- Inhibidores indirectos del factor Xa:
- Heparina no fraccionada (HNF): heparina sódica y cálcica
- Heparinas de bajo peso molecular (HBPM): enoxaparina, nadroparina, dalteparina, bemiparina, tinzaparina, etc.
- Derivados sintéticos: fondaparinux, idraparinux
- Antagonistas de vitamina K (cumarinas): impiden la síntesis hepática de los factores de la coagulación dependientes de la vitamina K: warfarina, acenocumarol
- Inhibidores directos. Son aquellos que por sí solos son capaces de inhibir la cascada de la coagulación:
- Inhibidores directos de la trombina:
- Derivados parenterales de la hirudina: desirudina, lepirudina, bivalirudina
- Peptidomiméticos orales: dabigatrán
- Inhibidores directos del factor Xa: rivaroxabán, apixabán, edoxabán, betrixabán, etc.
- Moduladores de la vía de la proteína C: Proteína C humana.
Los anticoagulantes cumarínicos han demostrado su eficacia para prevenir los accidentes cardiovasculares en pacientes con fibrilación auricular, pero su uso requiere unas condiciones especiales tanto por los pacientes como por los profesionales sanitarios que lo complican notablemente, especialmente debido a su estrecho margen terapéutico – debido al riesgo de hemorragias graves incluso con dosis terapéuticas – y a la variabilidad en la respuesta anticoagulante (incluso en un mismo paciente) que requiere una monitorización clínica rutinaria y, especialmente, del estado de la coagulación.
También los anticoagulantes cumarínicos han demostrado incuestionablemente su eficacia para prevenir nuevos episodios en pacientes que han experimentado un cuadro agudo de tromboembolismo venoso; sin embargo, su acción tiene un inicio relativamente lento, por lo que al menos durante 5-10 días precisan de la administración de anticoagulantes parenterales de tipo heparina (fraccionada o no), hasta normalizar el estatus coagulante adecuado (con valores INR1 entre 2 y 3). Las heparinas fraccionadas (o de bajo peso molecular, HBPM) son ampliamente utilizadas como antitrombóticos en la profilaxis de la TVP en pacientes sometidos a cirugía de alto riesgo (ortopédica-traumatológica, etc.) y en otras situaciones (circulación sanguínea extracorpórea, angina inestable, infarto de miocardio, etc.), pero requieren una administración parenteral (subcutánea) que, aunque facilitada con las plumas inyectoras con agujas extrafinas, supone un cierto inconveniente para algunos pacientes.
Los nuevos anticoagulantes orales de acción directa (inhibidores directos) tienen la ventaja de producir efectos más previsibles y no requieren una monitorización analítica y clínica tan estrecha como los cumarínicos; sin embargo, en su contra figura la rápida pérdida del efecto anticoagulante – con el consiguiente incremento del riesgo trombótico – en caso de falta de adherencia y la inexistencia2 de antídotos específicos. Por otro lado, la mayoría de los ensayos clínicos demostrativos de su eficacia clínica presentan una notable heterogeneidad en la población estudiada y en la calidad de la anticoagulación realizada con derivados cumarínicos, lo cual limita la relevancia clínica de las observaciones (Gómez Outes, 2013)3.
ACCIÓN Y MECANISMO
El edoxabán es un agente antitrombótico autorizado para la prevención del ictus y de la embolia sistémica en pacientes adultos con fibrilación auricular no valvular (FANV) con uno o más factores de riesgo tales como insuficiencia cardiaca congestiva, hipertensión, edad ≥75 años, diabetes mellitus, ictus o ataque isquémico transitorio; asimismo, está indicado en el tratamiento de la trombosis venosa profunda (TVP) y la embolia pulmonar (EB), y la prevención de las recurrencias de la TVP y la EP en adultos.
Actúa inhibiendo de forma directa, competitiva, selectiva y reversible el Factor Xa, una serina proteasa que ocupa una posición crítica en el proceso de coagulación, catalizando la conversión de la protrombina (Factor II) en trombina (Factor IIa). El edoxabán se une al Factor Xa en dos puntos diferentes (S1 y S4), donde ejerce su efecto inhibidor con carácter irreversible, los mismos puntos donde se fijan el apixabán y el rivaroxabán EMA, 2015). Una molécula de Factor Xa cataliza la formación de aproximadamente 1.000 moléculas de trombina. De esta manera, la inhibición del Factor Xa es susceptible de prevenir de forma eficaz los trombos arteriales ricos en plaquetas y los trombos venosos ricos en fibrina. La inhibición selectiva del Factor Xa por edoxabán puede inhibir la formación de trombina, pero permite que la trombina previamente formada efectúe sus funciones normales en la hemostasia.
ASPECTOS MOLECULARES
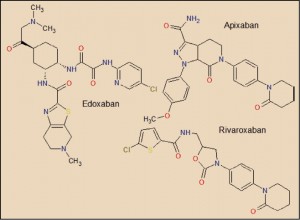
El edoxabán está estructuralmente relacionado con el apixabán y el rivaroxabán, si bien el parecido química entre estos dos últimos es más evidente. En cualquier caso, la estructura del edoxabán emula – como en los dos anteriores – la de un pequeño péptido, por lo que es capaz de actuar como falso sustrato que compite con la zona de rotura de la protrombina por el centro enzimático activo del Factor Xa, al que se une con elevada afinidad provocando su bloqueo de forma reversible.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas del edoxabán han sido adecuadamente contrastadas en las indicaciones autorizadas mediante sendos ensayos clínicos de fase III (confirmatorios de eficacia y seguridad), aleatorizados, multicéntricos y multinacionales, doblemente ciegos y con doble simulación, y controlados con un comparador activo – la warfarina – en ambos casos.
Fibrilación auricular de riesgo moderado o alto
En el ensayo clínico ENGAGE AF-TIMI 48 (Giugliano, 2013) se estudió el efecto de dos posologías de edoxabán vs. warfarina en 21.105 adultos (≥21 años) con fibrilación auricular de riesgo moderado o alto4 (CHADS2 ≥2; siendo la puntuación media de 2,8, un 53% ≥3), de origen no valvular, durante al menos un año, estuviesen o no tratados previamente con anticoagulantes o antiagregantes plaquetarios. Las características fisiopatológicas y demográficas globales fueron: media de 72 años (40% >75 años y 17% >80), 81% caucásicos, 62% varones, con una media de peso de 84 kg (18% >100 kg) y un índice de masa corporal (IMC) medio de 29,5 kg/m2 (40% >30); un 19% de los pacientes presentaban valores de aclaramiento de creatinina (CrCL) ≤50 ml/min. Más del 65% estaban recibiendo tratamiento con antihipertensivos de activos sobre el sistema renina-angiotensina (IECA o ARA II) o betabloqueantes, 60% diuréticos, 48% hipolipemiantes, 31% bloqueantes de canales de calcio y 30% ácido acetilsalicílico. Un 49% procedía de Europa (34% oriental y 15% occidental), un 22% de Norteamérica, un 13% de Latinoamérica y un 16% de Asia/Pacífico (5% de Japón).
Los pacientes fueron asignados aleatoriamente a uno de los siguientes tres brazos de tratamiento: edoxabán 60 mg o edoxabán 30 mg/24 h o warfarina dosificada para ajustar el INR entre 2 y 3 (en estos pacientes la mediana de tiempo en que se mantuvo entre estos valores fue el 68% del total). Los pacientes con insuficiencia renal, con ≤60 kg o tratados con verapamilo, quinidina o dronedarona (potenciales interacciones con edoxabán) tratados con edoxabán recibieron un 50% de la dosis planificada (30 o 15 mg/24 h). La mediana de duración del tratamiento con edoxabán fue de 2,5 años y la del seguimiento de los pacientes fue de 2,8 años, totalizando un seguimiento de 19.191 sujetos-año con la dosis de 60 mg y de 19.216 con la de 30.
Los resultados obtenidos en relación a la variable primaria de eficacia (tasa combinada de ictus y acontecimientos embólicos sistémicos anualizada; es decir, número de eventos/sujetos-año de exposición) mostraron unos valores de 1,61% por año entre los pacientes tratados con edoxabán 30 (15) mg, 1,18% con 60 (30) mg de edoxabán y 1,50% con warfarina, siendo la diferencia favorable entre la dosis de 60 mg de edoxabán y la warfarina estadísticamente significativa (HR=0,79; IC97,5% 0,632 a 0,985; p<0,0001), no así la de 30(15) mg, que fue desfavorable (HR=1,07; IC97,5% 0,874 a 1,314; p=0,0055). No obstante, la dosis de 60 (30) mg de edoxabán no fue considerada superior warfarina, sino no inferior, ya que el límite superior del intervalo de confianza para el 97,5% (IC97,5%) de la tasa de riesgo (HR) estaba por debajo del margen de no inferioridad de 1,38 previamente establecido.
Al estratificar la muestra en subpoblaciones según el tipo de acontecimiento embólico, las tasas anualizadas de ictus isquémico para edoxabán 60 (30) mg y warfarina fueron de 0,87 vs. 0,93% (HR=0,94; IC95% 0,746 a 1,193; p=0,6258), las de ictus hemorrágico de 0,26 vs. 0,49% (HR=0,53; IC95% 0,362 a 0,778; p=0,0012) y las de eventos embólicos sistémicos de 0,05 vs. 0,08% (HR=0,62; IC95% 0,257 a 1,497; p=0,2884). Por otro lado, considerando específicamente los datos por intención de tratar (ITT) para intentar demostrar la superioridad, la tasa anualizada de ictus o eventos tromboembólicos fue del 1,57% con edoxabán 60 (30) mg, de 2,04% con edoxabán 30 (15) mg y de 1,80% con warfarina. En comparación con los sujetos tratados con warfarina, la tasa de riesgo (HR) en el grupo de edoxabán 60 (39) mg fue de 0,87 (IC99% 0,709 a 1,068).
Desde el punto de vista de la variable primaria de seguridad, la tasa anualizada de hemorragia grave fue del 3,43% con warfarina vs. 2,75% con la dosis de 60 (30) mg de edoxabán (HR=0,80, IC95% 0,71 a 0,91; p<0,0001) y 1,61% con la dosis de 30 (15) mg de edoxabán (HR=0,47, IC95% 0,41 a 0,55; p<0,0001). Asimismo, las tasas anualizadas de mortalidad de origen cardiovasculares fueron del 3,17% con warfarina vs. 2,74% con la dosis de 60 (30) mg de edoxabán (HR=0,86, IC95% 0,77 a 0,97; p=0,01) y 2,71% con la dosis de 30 (15) mg de edoxabán (HR=0,85, IC95% 0,76 a 0,96; p=0,008).
Las tasas anualizadas de la variable secundaria compuesta (una combinación de casos de ictus, eventos embólicos sistémicos o muerte de origen cardiovascular) fueron del 4,43% con warfarina vs. 3,85% con la dosis de 60 (30) mg de edoxabán (HR=0,87, IC95% 0,78 a 0,96; p=0,01) y 4,23% con la dosis de 30 (15) mg de edoxabán (HR=0,95, IC95% 0,86 a 1,05; p=0,32).
Trombosis venosa profunda (TVP) y embolia pulmonar (EP)
En el ensayo clínico Hokusai-VTE (Hokusai-VTE, 2013) se estudió el efecto del edoxabán vs. warfarina en 8.240 adultos con un episodio agudo de tromboembolismo venoso o de embolia pulmonar. Un 70% eran de raza caucásica (blanca) y un 21% eran asiáticos. Los pacientes fueron tratados inicialmente (5-12 días) con heparina y posteriormente fueron asignados aleatoriamente a uno de los dos brazos de tratamiento: edoxabán 60 mg (o 30 mg/24 h en caso de aclaramiento de creatinina entre 30 y 50 ml/min, o con un peso corporal inferior a 60 kg o que estuviesen bajo tratamientos con fármacos potentes inhibidores de la proteína P) o warfarina dosificada para ajustar el INR entre 2 y 3 (en estos pacientes la mediana de tiempo en que se mantuvo el INR entre estos valores fue el 63,5% del total). La duración del tratamiento fue de 3 a 12 meses.
Las características fisiopatológicas y demográficas globales fueron: mediana de 57 años (33% ≥65 años y 13% ≥75), 70% caucásicos y 21% asiáticos, 57% varones; un 40,7% presentan embolia pulmonar (14,3% con trombosis venosa profunda y un 26,4% sin ella) y un 59,3% solo trombosis venosa profunda. La duración establecida del tratamiento fue de 3 meses en el 5,7%, de 6 meses en el 37,1% y de 12 meses en el 57,2%, utilizándose la dosis reducida de edoxabán (30 mg/24 h) en el 17,6% de los pacientes, de acuerdo a los criterios antes indicados. Un 58% procedía de Europa, un 23% de Asia/Pacífico, un 10% de Norteamérica y el resto de otras localizaciones geográficas. En total, 4.118 pacientes recibieron al menos una dosis de edoxabán y 4.122 de warfarina.
La variable primaria de eficacia consistió en la tasa de recurrencia del tromboembolismo venoso (una variable compuesta por el número de pacientes con episodios recurrentes de tromboembolismo venoso profundo y los de embolia pulmonar, tanto fatal como no fatal) durante el periodo total del estudio (12 meses), según un análisis por intención de tratar modificado (ITTm5).
Los resultados obtenidos mostraron unos valores de 3,2% entre los pacientes tratados con edoxabán y 3,5% con warfarina, encontrándose que el edoxabán no fue inferior a la warfarina (HR=0,89; IC95% 0,70 a 1,13; p<0,0001 para la no inferioridad y p=0,3362 para superioridad). En concreto, según el tipo de la recurrencia del episodio tromboembólico, fue de embolia pulmonar (con o sin trombosis venosa profunda) en el 1,8% con edoxabán y del 2,0% con warfarina, un 0,6% mortales en ambas ramas de tratamiento y un 1,2 vs. 1,4% no mortales; en el subgrupo de pacientes con embolia pulmonar con disfunción ventricular izquierda (938 pacientes), la tasa de tromboembolismo venoso fue del 3,3 vs. 6,2% (HR=0,52; IC95% 0,28 a 0,98). La tasa de episodios exclusivos de trombosis venosa profunda fue del 1,4 vs. 1,5%, mientras que la variable compuesta formada por la tasa de tromboembolismo venoso recurrente y la de mortalidad por cualquier causa mostró unos resultados del 5,5% tanto con edoxabán como con warfarina (HR=1,00; IC95% 0,832 a 1,200; p=0,9933). La estratificación de los pacientes según 55 criterios fisiopatológicos y farmacológicos, no mostró ninguna diferencias estadísticamente significativa entre edoxabán y warfarina, aunque con tendencias favorables al edoxabán en pacientes frágiles, en mayores de 75 años y en aquellos con historial de cáncer, aunque no estadísticamente significativas. En cuanto a la variable principal de seguridad (porcentaje de pacientes con sangrado clínicamente relevante), la tasa fue del 8,5% con edoxabán y del 10,3% con warfarina (HR=0,81; IC95% 0,71 a 0,94; p=0,004 para superioridad).
Desde el punto de vista de la seguridad, el edoxabán presenta un perfil toxicológico predecible y equiparable al de otros agentes anticoagulantes inhibidores directos del Factor Xa, como el apixabán y el rivaroxabán, destacando por encima de todo las hemorragias en la piel y tejidos blandos, epistaxis y hemorragias vaginales. Los sangrados fueron clínicamente relevantes en el 6,6% (dosis de 30 mg/24 h) y 8,7% (60 mg/24 h) de los pacientes tratados con edoxabán y en el 10,2% con warfarina, en pacientes con fibrilación auricular, y en el 8,5 % (edoxabán 60 mg/24 h) vs. 10,3% (warfarina) de los pacientes con tromboembolismo venoso; no obstante, en este último grupo las tasas fueron diferentes según que los pacientes se mantuviesen al menos un 60% del tiempo dentro del rango anticoagulante terapéutico6 (9,2 vs. 10,0%; HR=0,91; p>0,05) o no (6,9 vs. 10,9%; HR=0,61; p<0,05). Otros efectos adversos comunes son anemia (4,2% para edoxabán vs. 2,9% con warfarina), diarrea (6,3 vs. 6,0%), náusea (3,4 vs. 2,8%), gastritis (2,1 vs. 1,9%), dispepsia (1,8 vs. 1,6%) y alteraciones en los valores funcionales de diversos enzimas hepáticos (0,6 vs. 0,6%).
Las respectivas frecuencias de eventos adversos graves (serios) emergentes durante el tratamiento con edoxabán fue del 3,3% (30 mg/24 h) y del 4,7% (60 mg/24 h) vs. 6,6% con warfarina en pacientes con fibrilación auricular, y del 2,6% con edoxabán y 5,1% con warfarina en pacientes con tromboembolismo venoso. Asimismo, los respectivos porcentajes de pacientes con eventos adversos graves con desenlace mortal fueron del 4,1/4,4% con edoxabán vs. 5,2% con warfarina en fibrilación auricular y del 1,9% con edoxabán y 1,8% con warfarina en pacientes con tromboembolismo venoso. Finalmente, los porcentajes de pacientes con eventos adversos graves emergentes durante el tratamiento que obligaron a su suspensión definitiva fueron del 12,7/15,1% con edoxabán vs. 15,0% con warfarina en fibrilación auricular y del 7,1% con edoxabán y 6,9% con warfarina en pacientes con tromboembolismo venoso.
ASPECTOS INNOVADORES
El edoxabán es un agente antitrombótico autorizado para la prevención del ictus y de la embolia sistémica en pacientes adultos con fibrilación auricular no valvular con uno o más factores de riesgo tales como insuficiencia cardiaca congestiva, hipertensión, edad ≥75 años, diabetes mellitus, ictus o ataque isquémico transitorio; asimismo, está indicado en el tratamiento de la trombosis venosa profunda (TVP) y la embolia pulmonar (EB), y la prevención de las recurrencias de la TVP y la EP en adultos. Actúa inhibiendo de forma directa, competitiva, selectiva y reversible el Factor Xa, una serina proteasa que ocupa una posición crítica en el proceso de coagulación, catalizando la conversión de la protrombina (Factor II) en trombina (Factor IIa). El edoxabán está estructural y farmacológicamente relacionado con el apixabán y el rivaroxabán.
La eficacia y la seguridad clínicas del edoxabán han sido adecuadamente contrastadas en las indicaciones autorizadas mediante sendos ensayos clínicos de fase III (confirmatorios de eficacia y seguridad), aleatorizados, multicéntricos y multinacionales, doblemente ciegos y con doble simulación, y controlados con un comparador activo – la warfarina – en ambos casos.
Los resultados obtenidos en la prevención del ictus y de la embolia sistémica en pacientes con fibrilación auricular no valvular mostraron una tasa anualizada y combinada de ictus y acontecimientos embólicos sistémicos de 1,61% por año con edoxabán 30 mg, de 1,18% con la dosis de 60 mg y de 1,50% con warfarina, siendo la diferencia favorable entre la dosis de 60 mg de edoxabán y la warfarina estadísticamente significativa, aunque no fue considerada superior a warfarina (solo no inferior), ya que el límite superior del intervalo de confianza para el 97,5% (IC97,5%) de la tasa de riesgo (HR) estaba por debajo del margen de no inferioridad previamente establecido.
Por lo que respecta al tratamiento y prevención de la recurrencia de la trombosis venosa profunda y la embolia pulmonar, los resultados obtenidos mostraron unos valores de 3,2% entre los pacientes tratados con edoxabán y 3,5% con warfarina, encontrándose que el edoxabán no fue inferior a la warfarina.
Los datos clínicos indican que el edoxabán no es inferior a la warfarina en las dos indicaciones autorizadas, con algunas ventajas relativas a la menor incidencia de hemorragias intracraneales, pero mayor de las digestivas. En ambas indicaciones, el edoxabán mostró en general un menor riesgo de sangrado clínicamente relevante que la warfarina; no obstante, en los pacientes con tromboembolismo venoso que mantengan su INR dentro del margen terapéutico (2-3) durante al menos un 60% del tiempo, las diferencias con la warfarina no llegan a ser estadísticamente significativas.
Un metanálisis (Robertson, 2015) concluye en que no hay diferencias entre los anticoagulantes de acción directa y la anticoagulación estándar para el tratamiento a largo plazo de la embolia pulmonar. Otro metanálisis (Bruins, 2013) ha indicado que los inhibidores del factor Xa reducen significativamente el número de accidentes cerebrovasculares y de eventos embólicos sistémicos en comparación con warfarina en los pacientes con fibrilación auricular. Los inhibidores del factor Xa también parecen reducir el número de hemorragias y hemorragias intracraneales graves en comparación con warfarina, aunque las pruebas de una reducción de las hemorragias graves son menos consistentes.
Actualmente no existen pruebas definitivas para determinar qué inhibidor del factor Xa es más efectivo y más seguro para el tratamiento anticoagulante a largo plazo en pacientes con fibrilación auricular o en tromboembolismo venoso, debido a que aún no se realizaron estudios directos entre ellos. Tampoco se han encontrado (Providência, 2014) diferencias significativas entre los inhibidores de la trombina y los del Factor Xa, o entre regímenes posológicos cada 12 o 24 h, registrándose incluso en determinados grupos peores resultados que con warfarina.
Sea como fuere, no hay datos que avalen que el edoxabán presenta un mejor perfil terapéutico o de seguridad que sus antecedentes farmacológicos, rivaroxabán y apixabán.
|
VALORACIÓN |
|
EDOXABAN
|
|
Grupo Terapéutico (ATC): B01AF. SANGRE Y ÓRGANOS HEMATOPOYÉTICOS. Antitrombóticos: inhibidores directos del Factor Xa. |
|
Indicaciones autorizadas: Prevención del ictus y de la embolia sistémica en pacientes adultos con fibrilación auricular no valvular (FANV) con uno o más factores de riesgo tales como insuficiencia cardiaca congestiva, hipertensión, edad ≥75 años, diabetes mellitus, ictus o ataque isquémico transitorio; asimismo, está indicado en el tratamiento de la trombosis venosa profunda (TVP) y la embolia pulmonar (EB), y la prevención de las recurrencias de la TVP y la EP en adultos. |
|
SIN INNOVACIÓN. No implica aparentemente ninguna mejora farmacológica ni clínica en el tratamiento de las indicaciones autorizadas. |
|
FÁRMACOS RELACIONADOS REGISTRADOS EN ESPAÑA |
|||
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Rivaroxabán |
Xarelto |
Bayer |
2009 |
|
Apixabán |
Eliquis |
Bristol Myers Squibb |
2011 |
|
Edoxabán |
Daiichy Sankyo |
Lixiana |
2016 |
BIBLIOGRAFÍA
Bibliografía
- Benedí González J, Iglesias Peinado I. Fármacos anticoagulantes, antiagregantes plaquetarios y antitrombóticos. Fármacos antihemorrágicos. En: Terapéutica farmacológica de los trastornos cardiovasculares, renales y hematológicos. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2012. pp. 179-216.
- Bruins Slot K, Berge E. Inhibidores del factor Xa versus antagonistas de la vitamina K para la prevención de la embolia cerebral o sistémica en pacientes con fibrilación auricular. Cochrane Database of Systematic Reviews 2013 Issue 8. Art. No.: CD008980. DOI: 10.1002/14651858. CD008980
- Camm AJ, Kirchhof P, Lip GY, Schotten U, Savelieva I, Ernst S, et al; European Heart Rhythm Association; European Association for Cardio-Thoracic Surgery. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J. 2010; 31(19): 2369-429. doi: 10.1093/eurheartj/ehq278.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- European Medicines Agency (EMA). Lixiana®. European Public Assessment Report (EPAR). EMA/277184/2015; EMEA/H/C/002629. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002629/WC500189047.pdf
- Giugliano RP, Ruff CT, Braunwald E, Murphy SA, Wiviott SD, Halperin JL, et al; ENGAGE AF-TIMI 48 Investigators. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2013; 369(22): 2093-104. doi: 10.1056/NEJMoa1310907.
- Gómez-Doblas JJ, Muñiz J, Alonso Martin JJ, Rodríguez-Roca G, Lobos JM, Awamleh P, et al; colaboradores del estudio OFRECE. Prevalencia de fibrilación auricular en España. Resultados del estudio OFRECE. Rev Esp Cardiol. 2014; 67: 259-69. DOI: 10.1016/j.recesp.2013.07.015.
- Gómez-Outes A, Terleira-Fernández AI, Calvo-Rojas G, Suárez-Gea ML, Vargas-Castrillón E. Direct oral anticoagulants for stroke prevention in patients with atrial fibrillation: meta-analysis by geographic region with a focus on European patients. Br J Clin Pharmacol. 2016; 82(3): 633-44. doi: 10.1111/bcp.13005.
- Hokusai-VTE Investigators; Büller HR, Décousus H, Grosso MA, Mercuri M, Middeldorp S, Prins MH, et al. Edoxaban versus warfarin for the treatment of symptomatic venous thromboembolism. N Engl J Med. 2013; 369(15): 1406-15. doi: 10.1056/NEJMoa1306638.
- January CT, Wann LS, Alpert JS, Calkins H, Cigarroa JE, Cleveland JC Jr, et al; American College of Cardiology/American Heart Association
- Task Force on Practice Guidelines. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol. 2014; 64(21): e1-76. doi: 10.1016/j.jacc.2014.03.022.
- Providência R, Grove EL, Husted S, Barra S, Boveda S, Morais J. A meta-analysis of phase III randomized controlled trials with novel oral anticoagulants in atrial fibrillation: comparisons between direct thrombin inhibitors vs. factor Xa inhibitors and different dosing regimens. Thromb Res. 2014; 134(6): 1253-64.
- Robertson L, Kesteven P, McCaslin J. Inhibidores de trombina directa o inhibidores del factor Xa por vía oral para el tratamiento de la embolia pulmonar. Cochrane Database of Systematic Reviews 2015 Issue 12. Art. No.: CD010957. DOI: 10.1002/14651858. CD010957
1 International Normalized Ratio (INR). Este índice expresa la relación entre el valor del tiempo de protrombina de una persona concreta (un paciente) con respecto al valor medio considerado con fisiológico (estándar). En los pacientes que utilicen anticoagulantes, cuanto más próximo a 1 sea el valor del INR tanto menor es el efecto anticoagulante conseguido; en general, la pauta posológica anticoagulante se ajusta de tal manera para que el INR del paciente anticoagulado esté comprendido entre 2 y 3 en el caso de la prevención de patologías tromboembólicas o entre 3 y 4 cuando se trata de pacientes de alto riesgo sometidos a cirugía de sustitución valvular. Valores del INR por encima de 4 implican un elevado riesgo de hemorragia.
2 Aunque ya está disponible el idarucizumab, un anticuerpo monoclonal que es capaz de revertir rápida y eficazmente la actividad anticoagulante del dabigatrán.
3 Por ejemplo, no encontraron diferencias significativas en la eficacia antitrombótica en prevención de accidentes cerebrovasculares entre los anticoagulantes de acción directa y la warfarina en estudios realizados en Europa, pero sí los encontraron en estudios realizados en otras localizaciones geográficas. No obstante, sí se constató un menor riesgo hemorrágico con los anticoagulantes de acción directa en todas las localizaciones geográficas.
4 La escala CHADS2 permite evaluar el riesgo de ictus en pacientes con fibrilación auricular, puntuándolo entre 0 y 6. Está formado por la presencia o ausencia de cinco condiciones: insuficiencia cardiaca congestiva (C), hipertensión (H), edad≥75 años (A), diabetes mellitus (D) e ictus previo (S); cada condición presente se valora con un punto, salvo el ictus previo, que puntúa doble (de ahí el término S2). Una puntuación de 0 supone un bajo riesgo (1,9% riesgo de ictus), de 1 se considera moderado (2,8%), 2 es también moderado (4,0%) y a partir de ahí el riesgo es alto: 3 (5,9%), 4 (8,5%), 5 (12,5%) y 6 (18,2%). En general, las guías clínicas consideran que con CHADS2 de 0 puede requerir un tratamiento antiagregante plaquetario, con un valor de 1 (bajo a moderado) se puede optar entre un tratamiento antiagregante plaquetario o con anticoagulante oral ajustado para un INR entre 2 y 3; con valores ≥2 (moderado o alto), siempre es aconsejable el tratamiento anticoagulante.
5 Sujetos incluidos aleatoriamente en uno de los grupos de tratamiento, que hubieran recibido al menos una dosis del fármaco correspondiente.
6 INR=2-3.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares





