Dolutegravir TIVICAY® (GlaxoSmithKline)
 Nº377
Nº377
VIH/SIDA
El objetivo esencial de la terapia antirretroviral (TAR) es maximizar la supresión permanente de la replicación del VIH, con el fin de limitar el desarrollo de resistencia viral y de restaurar la función inmunológica, reduciendo con ello la morbilidad y la mortalidad asociadas, mejorando la calidad de vida del paciente y previniendo la transmisión del VIH. En este sentido, el estándar terapéutico de supresión de la replicación viral es aquel que asegure al máximo una carga viral plasmática (CVP) estable por debajo de 50 copias/ml.
Dolutegravir es un agente antiviral directo que actúa inhibiendo la integrasa del VIH, un enzima codificado por el virus que facilita la integración (inserción) del genoma del VIH en el genoma de la célula huésped (linfocitos T). Está relacionado química y farmacológicamente con raltegravir y elvitegravir, previamente registrados. Ha sido autorizado para el tratamiento de adultos y adolescentes mayores de 12 años infectados por el Virus de Inmunodeficiencia Humana (VIH), en combinación con otros medicamentos antirretrovirales.
Presenta un perfil farmacocinético es más favorable que el de sus antecesores de este grupo, con una semivida celular prolongada que facilita una única administración diaria, sin necesidad de bloqueantes enzimáticos adicionales (como el cobicistat, en el caso del elvitegravir) y además es metabolizado mayoritariamente por una vía ajena a los isoenzimas del citocromo p450, lo que limita notablemente el número y la relevancia de las interacciones con otros fármacos, incluyendo la mayoría de los antirretrovirales. Todo ello, unido a la utilidad en pacientes que previamente habían fracasado con raltegravir o elvitegravir, le aporta un significativo valor añadido y viene a consolidar la relevancia de los inhibidores de la integrasa como fármacos de primera consideración en el tratamiento de la infección por VIH.
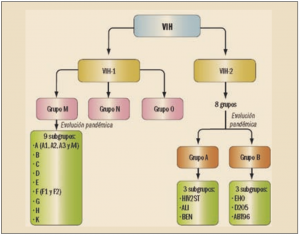
El VIH es un retrovirus, esto es, un virus ARN, que depende de un enzima, la transcriptasa inversa, para dar lugar a una cadena de ADN que, por la acción de otro enzima, una integrasa, se inserta en el genoma del hospedador. Forma parte de los lentivirus, una subfamilia cuyo nombre alude a la forma insidiosa (lenta e inicialmente desapercibida) en que se desarrolla su infección.
En 1983 se identificó el primer tipo de VIH (VIH-1), el más distribuido a nivel mundial, y en 1986 un segundo (VIH-2), de distribución más restringida. Se han descrito numerosos subtipos, algunos de los cuales han evolucionado mayoritariamente de forma pandémica, pero también se han identificado cepas recombinantes intersubtipo. Esta gran variabilidad que presenta es uno de los inconvenientes para conseguir un tratamiento eficaz. Tanto el VIH-1 como el VIH-2 son capaces de provocar el sida, si bien el VIH-2 se asocia más frecuentemente que el VIH-1 con el desarrollo de las formas neurológicas del síndrome.
El VIH-1 puede presentar cepas más o menos patógenas, con distinto tropismo celular; las cepas del grupo O son naturalmente resistentes a inhibidores de la transcriptasa inversa no análogos de los nucleósidos; en los distintos subgrupos del grupo M, algunas cepas del subtipo G son menos sensibles in vitro a inhibidores de la proteasa; y algunas mutaciones que condicionan la resistencia a inhibidores de la transcriptasa inversa no nucleósidos son más frecuentes, por ejemplo, en el subgrupo C que en el B. El VIH-2 no es sensible a los inhibidores de la transcriptasa inversa no análogos de los nucleósidos y, para algunos subtipos, la determinación de carga viral (criterio fundamental en el manejo actual de la infección por el VIH) puede dar resultados falsamente negativos.
Los VIH son virus de geometría esférica, con un diámetro medio aproximado de 100 nm (Figura 2). La capa más externa o cubierta está formada por una membrana lipídica derivada de la célula hospedadora, con un alto contenido en lipoproteínas. En dicha membrana se insertan antígenos de histocompatibilidad (HLA) del hospedador, que le permitirán una primera unión a la célula hospedadora y multitud de complejos heterodiméricos de glucoproteínas, compuestos por trímeros de la glicoproteína de superficie gp120 y de la glicoproteína transmembrana gp41. Por debajo de la membrana lipídica se encuentra la matriz proteica, formada por la proteína p17, que recubre a la cápsula o cápside propiamente dicha, constituida por la proteína p24. Dentro de la cápside se encuentran el material genético –que se presentará como dos hebras idénticas de ARN monocatenario–, la nucleoproteína y algunas enzimas (entre otras, la transcriptasa inversa). La transcriptasa inversa va a facilitar la formación, a partir del ARN, de una doble cadena de ADN, que se insertará en el material genético de la célula hospedadora.
En el genoma del VIH se incluyen varios genes: los gag, que codifican proteínas estructurales del núcleo y de la matriz, y los genes env, que codifican las glicoproteínas de la cubierta viral que intervienen en el reconocimiento de los receptores presentes en la superficie de las células "diana". También contiene genes pol, que codifican enzimas esenciales para el proceso de replicación viral y, entre ellas, la transcriptasa inversa, que permite la conversión del ARN viral en ADN, la integrasa, que facilita la incorporación del ADN viral al ADN de los cromosomas de las células huésped (provirus), y la proteasa, que facilita la escisión de las grandes proteínas precursoras inactivas gag y pol en sus formas activas.
Además de los genes mencionados, el ARN del VIH contiene otros genes, como tat, rev, vif, vpu, nef y vpx, que codifican proteínas reguladoras. En concreto, el gen tat codifica una proteína (Tat) que es expresada de forma precoz tras la infección y regula la expresión de otros genes del VIH. Por su parte, la proteína Rev facilita el paso del ARN mensajero desde el núcleo al citoplasma; la proteína Vpr parece estar implicada en la detención del ciclo celular y también capacita al ADN transcrito a partir del ARN viral a acceder al núcleo de células que no se encuentren en fase de división. La proteína Vpu es requerida para una liberación correcta de las partículas virales, en tanto que la Vif parece estar implicada en la infectividad del VIH. La proteína Nef tiene, entre otras, la misión de provocar una regulación a la baja de la expresión de los receptores CD4 en la superficie de las células huésped, facilitando así la gemación del virus en las fases finales del ciclo replicador. El virus se apodera de la maquinaria celular y silencia la replicación de numerosos genes celulares en favor de la replicación de los propios.
El VIH es un microorganismo extraordinariamente sensible al medio, no puede sobrevivir fuera del torrente sanguíneo o del tejido linfático y es fácilmente destruido por cualquier detergente o desinfectante al uso. Por este motivo, la transmisión del VIH entre personas ha de producirse a través de algún fluido biológico en el que pueda sobrevivir el VIH, fundamentalmente la sangre y algunas secreciones (vaginal, espermática, etc.), que entre en íntimo contacto con estructuras potencialmente receptoras, como los vasos sanguíneos, o pequeñas erosiones en la piel o las mucosas. Las principales vías de transmisión del VIH son la sexual, la parenteral y la vertical (madre-hijo), siendo la vía sexual la que origina más del 80% de los contagios a nivel mundial.
El VIH presenta tropismo por los macrófagos y los linfocitos T CD4. Las células infectadas por el VIH pueden transferir el virus a las células del sistema inmune local, presentes en el epitelio vaginal o en la mucosa anorrectal. En el caso de las relaciones heterosexuales –actualmente, la forma de transmisión más común–, el primer tejido en ser infectado es la mucosa cervical, donde pueden infectarse las células dendríticas y los linfocitos T CD4+. La proporción de linfocitos T CD4+ infectados en sangre periférica es mínima (1-10%), pero su capacidad de producir viriones es muy alta y, a partir de estos, la infección puede difundirse hacia los nódulos linfáticos regionales y, posteriormente, ser distribuida por todo el organismo a través del torrente circulatorio.
Ya en los nódulos linfáticos se produce una intensa replicación del VIH que en unos casos provoca la lisis de las células infectadas, pero en otros queda como una infección latente en los macrófagos y los linfocitos T en reposo. Justamente, son estos últimos los que actúan como "reservorios naturales" del VIH y dificultan notablemente la respuesta inmunológica del organismo y, en la misma medida, la adopción de medidas terapéuticas eficaces desde el mismo inicio de la infección. Sólo una pequeña proporción de los linfocitos infectados (1%) replica activamente el VIH en determinado momento, permaneciendo latente en la inmensa mayoría de ellos. Aún no se conoce bien de qué forma estas células con infección latente pasan a la replicación activa, pero los factores implicados en este proceso podrían constituir nuevas dianas terapéuticas, ya que el virus latente carece de efectos patológicos.
Apenas 10-12 días después del contagio ya se puede detectar el ARN viral en la sangre, lo que implica que el paciente está en condiciones de contagiar a otra persona. Tras la primera replicación viral después de la infección, la carga viral puede llegar a alcanzar valores de hasta 100 millones de copias por mL de sangre. Esta elevada viremia provoca una rápida respuesta del sistema inmunológico. La respuesta inmune frente al VIH-1 se produce en la vertiente humoral (con una intensa producción de anticuerpos contra las proteínas reguladoras y estructurales, así como producción de complemento e interferones) y en la celular (activación de poblaciones linfocitarias T colaboradoras, citotóxicas y de estirpe NK o natural killer). Se produce una intensa expansión clonal de linfocitos CD8+ con actividad citotóxica, dirigida frente a diversas proteínas del VIH-1, y que originan una cierta supresión de la replicación del VIH y una drástica disminución de la viremia –en varios órdenes de magnitud – pudiendo incluso hacerse indetectable en la sangre (generalmente, menos de 50 copias de ARN por mL).
Entre 3 y 5 semanas después de la infección, aparecen anticuerpos, lo que determina la seroconversión, ya que a partir de este momento el paciente se transforma en seropositivo. Aunque esta potente respuesta antiviral llega a contener la replicación vírica, es incapaz de erradicar el virus del organismo. En la fase crónica de la infección, estas respuestas se mantienen. Existe una persistente activación inmunológica por parte del virus y un control parcial de la masiva replicación viral por parte del sistema inmune durante largos periodos de tiempo. El pronóstico y la evolución de la infección dependerán del equilibrio entre la virulencia del virus y la respuesta inmunológica del huésped.
En los estadios finales de la enfermedad se produce un daño en el control inmunológico, con caída de linfocitos CD4+ y elevación de la carga viral, así como disminución de anticuerpos frente a diversas estructuras virales. La destrucción de los CD4+, que ocupan un lugar preeminente en la organización y la activación del sistema inmune, origina un deterioro funcional de otras poblaciones celulares. Esta situación define lo que denominamos SIDA, que va a caracterizarse por la aparición de infecciones oportunistas y tumores.
Existe un pequeño grupo de pacientes (5-10 %) con infección por el VIH-1 que presenta una progresión lenta o una ausencia de progresión hacia estas fases finales. Estos pacientes de progresión lenta mantienen una carga viral basal reducida y cifras de linfocitos CD4+ mantenidas por encima de 500/mm3 en ausencia de terapia específica. Probablemente, este grupo de población es un colectivo heterogéneo, en cuya protección están implicados diversos factores inmunológicos (potentes y variadas respuestas citotóxicas), virológicos (cepas virales con defectos estructurales) y genéticos (defectos en ciertos correceptores del VIH; por ejemplo, CCR5, CXCR4) que permiten esta evolución benigna de la infección.
Según las cifras de 2008 publicadas por la OMS, hay actualmente 33,4 millones de afectados por el VIH. Se estima que durante ese año resultaron infectadas por el virus 2,7 millones de personas, y que 2 millones murieron de SIDA. El África subsahariana continúa siendo la región más afectada por el VIH. En 2008, dicha región tenía el 67% de las infecciones por VIH a nivel mundial, 68% de los nuevos casos en los adultos y el 91% de las nuevas infecciones en los niños. Según el último informe publicado por el Registro Nacional de Sida, en 2011 se diagnosticaron en España 2.763 nuevos casos de infección por VIH, lo que supone una tasa de 84,1/millón de habitantes. El 83% eran hombres y la mediana de edad fue de 35 años.
El proceso infeccioso del virus de la deficiencia humana (VIH-1) comienza tras su inoculación por una replicación extraordinariamente rápida del virus en el tejido linfoide, que se contrarresta por la aceleración de las tasas de producción y destrucción de las células de defensa inmunitaria. Más de un 30% de las partículas virales presentes en el plasma de los pacientes se renuevan diariamente, lo que implica una vida media viral de menos de dos días, mientras que el ritmo diario de sustitución de los linfocitos CD4+ plasmáticos es de un millón, lo que supone entre 10 y 100 veces más de lo normal.
La primoinfección por el VIH-1 es sintomática en más de la mitad de los casos, pero puede pasar desapercibida ya que sus síntomas son los de una virosis común (como un resfriado o una gripe). Como en esta fase todavía no hay anticuerpos (período ventana), lo que puede determinarse es la carga viral plasmática (CVP), detectable a partir de la primera semana. La CVP en la infección aguda suele estar muy elevada – más de un millón (6 log10) de copias de ARN viral – y se relaciona con la intensidad de las manifestaciones clínicas, detectándose la seroconversión entre una y dos semanas más tarde. El término infección aguda, que implica el diagnóstico antes de la seroconversión (menos de 30 días), no debe confundirse con el de infección reciente, aquella que tiene menos de seis meses de evolución (menos de 180 días).
Las manifestaciones clínicas del SIDA solo aparecen cuando el sistema inmunitario pierde la batalla frente a la infección. La facilidad de mutación del VIH explica la escasa eficacia de la monoterapia antirretroviral, dado que su rapidez de replicación garantiza la aparición y diseminación de cepas resistentes a varios fármacos. En cualquier caso, la progresión de la infección a SIDA es más rápida en los pacientes inicialmente sintomáticos y se asocia a factores iniciales de la infección, como la gravedad de la sintomatología en la infección aguda (mayor riesgo a mayor número de síntomas), cuantía del descenso inicial del número de linfocitos CD4+ (mayor riesgo si es inferior a 500 células/μL), nivel de la CVP basal o a partir del cuarto mes (mayor progresión si es mayor de 5 log10 o 100.000 copias/mL), a la cuantía de ADN proviral inicial (mayor progresión si es mayor de 3,4 log10 copias/millón de células mononucleares en sangre periférica), a la infección por virus X4 o con tropismo D/M, a las infecciones por más de un virus VIH-1 y al perfil genético de los individuos infectados.
A la fase aguda le sigue una fase asintomática, de duración variable pero raramente inferior a 18 meses, durante la que el VIH continúa replicándose en diferentes compartimentos orgánicos, contrarrestando la respuesta inmunológica natural del organismo y provocando un estado inflamatorio de carácter crónico. Una pequeña proporción de pacientes son capaces de mantener una viremia indetectable durante años, lo que parece indicar que en ellos funciona adecuadamente el sistema inmunológico y son capaces de enfrentarse eficazmente al VIH a través de mecanismos estrictamente fisiológicos pero todavía desconocidos. Sin embargo, en la gran mayoría de los pacientes infectados por el VIH, a lo largo del periodo asintomático se va produciendo una progresiva reducción de los recuentos de linfocitos T CD4+ y de la eficacia del sistema inmunológico. Cuando se ha alcanzado un grado significativo de deterioro del tejido linfoide, fruto de la replicación viral y del estado inflamatorio crónico, la replicación viral vuelve a crecer y la difusión del VIH se generaliza por todo el organismo, dando lugar a recuentos de linfocitos T CD4+ por debajo de 200/μL, momento a partir del cual se considera la aparición del sida propiamente dicho, en el que el riesgo de nuevas infecciones, reactivación de infecciones latentes, aparición de infecciones oportunistas, o de algunas neoplasias es muy elevado y que, en última instancia, acabará provocando la muerte del paciente si no se adoptan las medidas adecuadas (Cuéllar, 2014).
Los microorganismos oportunistas causantes de infecciones más frecuentemente asociados a la inmunodeficiencia provocada por el VIH son varias especies de Mycobacterium (M. tuberculosis, complejo avium-intracellulare, etc.), Pneumocystis jiroveci (antes P. carinii), Candida albicans, Herpes simple y zóster, Citomegalovirus, Criptosporidium, Giardia, Isospora, etc. (Figura 3). En cuanto a las neoplasias emergentes como consecuencia del fracaso inmunológico, las más comúnmente relacionadas con el VIH son el sarcoma de Kaposi, ciertos linfomas y otros trastornos linfoproliferativos (como la leucoencefalopatía multifocal progresiva: LMP) ligados infecciones oportunistas por el virus del herpes humano de tipo 8 (VHH-8). No es infrecuente el desarrollo de una encefalopatía progresiva, a veces inducida por el propio VIH (que es capaz de infectar y replicarse en las células de la microglía, en el SNC).
En los pacientes infectados por el VIH se observan con frecuencia distintos síndromes clínicos (afecciones oculares, renales, hematológicas, alteraciones endocrinas y del metabolismo, neurológicas, gastrointestinales, pulmonares, adenopatías, síndrome febril, anorexia, afecciones cardiacas y manifestaciones reumatológicas) de diferente etiología, ya sean relacionados con la propia infección, con la aparición de nuevas infecciones o con el tratamiento antirretroviral. En definitiva, se estima que, en ausencia de tratamiento, el tiempo medio transcurrido entre la infección y la muerte del paciente es de 11 años.
El objetivo esencial de la terapia antirretroviral (TAR) es maximizar la supresión permanente de la replicación del VIH, con el fin de limitar el desarrollo de resistencia viral y de restaurar la función inmunológica, reduciendo con ello la morbilidad y la mortalidad asociadas, mejorando la calidad de vida del paciente y previniendo la transmisión del VIH. En este sentido, el estándar terapéutico de supresión de la replicación viral es aquel que asegure al máximo una carga viral plasmática (CVP) estable por debajo de 50 copias/ml.
Actualmente, según el Documento de Consenso Gesida/Plan Nacional sobre el Sida respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana (Berenguer, 2013) el inicio del tratamiento antirretroviral debe basarse en las manifestaciones clínicas, el número de linfocitos CD4+, la carga viral plasmática (CVP) y la presencia de otras patologías concomitantes.
En el caso de infección sintomática, se recomienda iniciar el tratamiento antirretroviral en todos los casos, pero en caso de infección asintomática el inicio del tratamiento está justificado:
- Cuando el nivel de linfocitos CD4+ sea inferior a 500 células/μL.
- En pacientes con determinadas comorbilidades (cirrosis hepática, hepatitis crónica por VHC, CVP >105 copias/mL, proporción de linfocitos CD4+ inferior al 14%, edad ≥55 años, riesgo cardiovascular elevado y trastornos neurocognitivos, etc.), incluso aunque el número de linfocitos CD4+ sea mayor de 500 células/μL.
Asimismo, en pacientes asintomáticos e independientemente del recuento de linfocitos CD4+, se recomienda el inicio del tratamiento antirretroviral en:
- Parejas serodiscordantes con alto riesgo de transmisión por vía sexual. En ningún caso ello debe suponer la abstención de otras medidas para impedir la transmisión del VIH.
- En mujeres gestantes, para prevenir la transmisión materno fetal.
- En la nefropatía VIH.
- En la hepatitis B que requiere tratamiento.
Los fármacos antirretrovirales disponibles actualmente son:
- Inhibidores de la transcriptasa inversa
- a. Inhibidores de la transcriptasa inversa análogos de nucleósidos o de nucleótidos (ITIAN): Fue el primer grupo disponible de fármacos activos contra VIH. Los primeros eran análogos de los nucleótidos naturales (ITIAN, inhibidores de la transcriptasa inversa análogos de nucléosidos o nucleótidos), con capacidad de impedir la síntesis de DNA viral a partir de la cadena de ARN infectante. Actúan como finalizadores de cadena: la transcriptasa inversa los incorpora como eslabones en la cadena de ADN en formación, pero es incapaz de unir a ellos el eslabón siguiente. Obstaculizan así la incorporación del ADN viral a la dotación genética de la célula infectada. La zidovudina fue el primer medicamento antirretroviral, es el más experimentado y se considera todavía la base del tratamiento. Como consideración muy general, hay dos perfiles distintos de efectos adversos dentro del grupo: la zidovudina y (con menor intensidad) la lamivudina tienen toxicidad hematológica (anemia y neutropenia) y gastrointestinal (náuseas). Didanosina y estavudina presentan, en grados diferentes, riesgo de neuropatía periférica y pancreatitis. Por su parte, abacavir produce reacciones hipersensibilidad en un 3% de los pacientes. El tenofovir fue el primero de una subclase de los ITIAN, los derivados nucleotídicos (a diferencia de los nucleosídicos), que presenta la peculiaridad de acortar el proceso bioquímico intracelular de fosforilación (un paso imprescindible para la activación farmacológica de estos medicamentos), además de facilitar su paso a través de las membranas celulares. La emtricitabina presenta un marcado parecido con la lamivudina, estructural, farmacológico y clínico.
- b. Inhibidores de la transcriptasa inversa no nucleósidos (ITINN): Su estructura química está muy alejada a la de los ITIAN. Los fármacos de este grupo que están actualmente disponibles son nevirapina, efavirenz, etravirina y rilpivirina. No parecen presentar resistencia cruzada con los derivados nucleosídicos (zidovudina, especialmente), aunque la resistencia frente a la propia nevirapina aparece de forma relativamente rápida, salvo que se utilice asociada con otros antirretrovirales (dos es el número mínimo recomendado). Los inhibidores no nucleosídicos de la transcriptasa inversa se unen al enzima en una zona relacionada aunque diferente de la utilizada por los ITIAN.
- Inhibidores de la proteasa (IP): Interfieren una etapa vital en el ensamblaje de nuevos viriones y la diseminación del virus. Una particularidad de la dotación genética del VIH es codificar muchas de sus proteínas vitales como precursores que tienen que ser recortados tras la síntesis para obtener las cadenas proteicas útiles. El corte de las cadenas precursoras está catalizado por una proteasa específica. Entre los componentes virales que no se forman sin la proteasa están la propia proteasa, la transcriptasa inversa y varias proteínas estructurales. Los inhibidores de la proteasa imitan la estructura química de los puntos de la cadena peptídica donde el enzima produce los cortes, bloqueando así la acción. La potencia antiviral es superior a la de los inhibidores de la transcriptasa inversa, pero son también muy susceptibles a las resistencias. Actualmente, están disponibles en España indinavir, ritonavir, saquinavir, nelfinavir, fosamprenavir, lopinavir, tipranavir y darunavir.
- Inhibidores de la fusión (IF). La enfuvirtida ha sido el primer agente de este grupo en recibir la autorización de comercialización. Actúa bloqueando la penetración del VIH-1 en los linfocitos T CD4+, al inhibir el proceso por el que la cubierta viral se funde con la membrana de los linfocitos, impidiendo la penetración viral en las células diana para el VIH en el sistema inmunológico humano. El mecanismo específico transcurre a través de la asociación con la subunidad glucoprotéica gp41 del VIH-1. Esta asociación impide el cambio conformacional requerido en la gp41 para fusionarse con la membrana de los linfocitos T CD4+.
- Inhibidores de la integrasa (InInt): El grupo está formado actualmente por raltegravir, elvitegravir y dolutegravir, cuya característica común es ser inhibidores de la integrasa del VIH, un enzima codificado por el virus que facilita la integración (inserción) del genoma del VIH en el genoma de la célula huésped (linfocitos T). Este proceso de integración genómica es indispensable para la replicación viral, dado que ésta depende de la maquinaria celular de duplicación del ADN, y se produce en cuatro pasos consecutivos: ensamblaje, procesamiento en 3', transferencia de hebras y reparación. De estos cuatros pasos, los tres primeros son catalizados por la integrasa. Los fármacos de este grupo actúan específicamente inhibiendo el tercer paso, la transferencia de hebras de la integrasa.
- Inhibidores del co-receptor CCR5. Maraviroc es el único fármaco comercializado en España que actúa inhibiendo el co-receptor humano de quimiocinas CCR5, impidiendo con ello la penetración del VIH con tropismo CCR5 (virus R5). Maraviroc carece de actividad frente a VIH con tropismo CXCR4 (virus X4) o con tropismo dual CCR5/CXCR4. Estos co-receptores son requeridos, junto con el CD4, para facilitar la unión de la membrana celular con la cápside del VIH y, en consecuencia, la penetración del contenido del virus en el citoplasma de la célula infectada. Las cepas que infectan a monocitos y macrófagos, que son las primeras seleccionadas por el VIH, son R5 o monocitotropas; después el virus evoluciona cambiando su tropismo hacia un tropismo CXC4 (X4), que son las que infectan preferentemente a los linfocitos. Maraviroc se une a la región proteica del co-receptor CCR5 exterior a la membrana, provocando un cambio estable de su conformación y haciéndola inasequible para las quimiocinas del VIH. Por tanto, se trata de una forma de inhibición alostérica no competitiva. De esta manera, el VIH con tropismo CCR5 no es capaz de actuar sobre tal co-receptor, impidiendo la unión del VIH a la célula y, consecuentemente, la infección por el VIH.
El tratamiento de elección de la infección por el VIH-1 en el momento actual consiste en una combinación de al menos tres fármacos que incluyan dos ITIAN asociado a un IP/r, un ITINN o un InInt. Con la mayoría de estas combinaciones se puede conseguir una CVP <50 copias/mL en más del 70% de los casos a las 48 semanas. La elección de una u otra familia se realiza según sus potenciales ventajas, entre otras:
- Interacciones farmacológicas (de menos a más): InInt, ITINN, IP/r;
- Mayor barrera genética: IP/r;
- Menor coste: ITINN (además el momento idóneo del uso de los ITINN de primera generación es el tratamiento inicial, ya que en las pautas de rescate tienen menos actividad que otras familias de FAR).
En resumen, puede utilizarse la combinación de 2 ITIAN + 1 ITINN, 2 ITIAN + 1 IP/r ó 2 ITIAN + InInt como tratamiento de inicio. Una pauta con dos ITIAN (preferentemente tenofovir/emtricitabina) y un inInt (raltegravir, dolutegravir o elvitegravir) tendría la ventaja de una mayor concentración en las secreciones genitales y podría reducir más rápidamente la CVP durante las primeras 4-8 semanas en comparación con los IP o ITINN, lo que podría facilitar la reducción de la transmisión del VIH. En cualquier caso, se debe efectuar siempre una prueba de resistencias y un tropismo viral al diagnóstico de la infección aguda o reciente, se vaya a iniciar el tratamiento o no. Si no se dispone del resultado del estudio de resistencias es preferible comenzar con una pauta basada en un IP/r hasta tener los resultados. La monoterapia con un IP/r no se recomienda como tratamiento de inicio, como tampoco se deben usar pautas sin un ITIAN. Lo que es fundamental considerar es que si se inicia el tratamiento antirretroviral, éste debe administrarse por tiempo indefinido y en aquellos que no estén incluidos en los anteriores criterios, se recomienda reevaluarlos a partir de los 6 meses, cuando la infección pasa a ser crónica.
Asimismo, las combinaciones de tres fármacos constituye el tratamiento de inicio de elección de la infección crónica por el VIH. El tratamiento antirretroviral es recomendado siempre en los pacientes sintomáticos, en las embarazadas, en las parejas serodiscordantes con alto riesgo de transmisión, en la hepatitis B que requiera tratamiento y en la nefropatía relacionada con el VIH. En los pacientes asintomáticos el inicio del tratamiento depende en la cifra de linfocitos CD4+, la carga viral plasmática, la edad y las comorbilidades del paciente. El esquema terapéutico debe incluir dos inhibidores de la transcriptasa inversa análogos de nucleósido o nucleótido y un tercer fármaco (inhibidor de la transcriptasa inversa no nucleósido, inhibidor de la proteasa potenciado o inhibidor de la integrasa). Se han seleccionado por consenso combinaciones concretas de fármacos, en concreto, las combinaciones de ITIAN de elección para regímenes de inicio son tenofovir/emtricitabina (TDF/FTC) o abacavir/lamivudina (ABC/3TC), recomendándose el uso de fármacos coformulados en un mismo medicamento.
Debe tenerse presente, no obstante, que la aparición de resistencias es un fenómeno inevitable cuando el VIH continúa replicando bajo presión selectiva de fármacos. La detección de las mutaciones de resistencias por métodos genotípicos es muy útil en el fracaso virológico. Las opciones terapéuticas tras el fracaso virológico son limitadas, pero actualmente puede conseguirse el objetivo de una CVP indetectable. Afortunadamente, la toxicidad es un factor cada vez menos limitante del tratamiento.
ACCIÓN Y MECANISMO
Dolutegravir es un agente antiviral directo que actúa inhibiendo la integrasa del VIH, un enzima codificado por el virus que facilita la integración (inserción) del genoma del VIH en el genoma de la célula huésped (linfocitos T). Ha sido autorizado para el tratamiento de adultos y adolescentes mayores de 12 años infectados por el Virus de Inmunodeficiencia Humana (VIH), en combinación con otros medicamentos antirretrovirales.
El proceso de integración genómica es indispensable para la replicación viral, dado que ésta depende de la maquinaria celular de duplicación del ADN, y se produce en cuatro pasos consecutivos: ensamblaje, procesamiento en 3', transferencia de hebras y reparación; de ellos, los tres primeros son catalizados por la integrasa y el dolutegravir actúa específicamente inhibiendo el tercer paso, la transferencia de hebras de la integrasa, con una concentración inhibitoria para el 50% (IC50%) de 0,2 a 2 nM, frente a valores de 7-10 nM para elvitegravir.
El dolutegravir presenta una elevada barrera frente al desarrollo de resistencia primaria por las cepas clínicas de VIH, hasta el punto de que, por el momento, no se haya descrito la emergencia de cepas resistentes en pacientes que previamente no habían tratados con inhibidores de la integrasa. La presencia de la mutación que conduce al cambios en la secuencia peptídica de la integrasa, por sustitución del aminoácido glutamina (Q, Gln) por otro (generalmente, arginina, R, Arg) en la posición 148 (Q148R), puede reducir sustancialmente la susceptibilidad al dolutegravir, aunque solo si va acompañada de al menos otras dos mutaciones secundarias (G140A/C/S, E138A/K/T o L74I); de hecho, por sí sola no afecta significativamente a la susceptibilidad del VIH al dolutegravir (la mutación Q148R está presente en el 40% de las cepas aisladas de pacientes resistente al raltegravir). Como ocurre con otros inhibidores de la integrasa, la administración conjunta de dolutegravir con otros antirretrovirales reduce la aparición de cepas de VIH resistentes al fármaco.
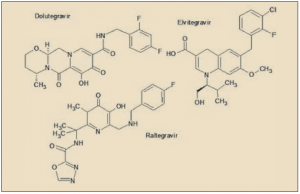
ASPECTOS MOLECULARES
El dolutegravir está estrechamente relacionado con sus antecesores farmacológicos, raltegravir y elvitegravir. Como estos, presenta una estructura pseudopeptídica que emula químicamente una fracción proteica y con ello es capaz de actuar de señuelo bioquímico para la integrasa del VIH, conduciendo a su bloqueo.
En términos químicos (denominación IUPAC), el dolutegravir es la (4R,12aS)-N-[(2,4-difluorofenil)metil]-7-hidroxi-4-metil-6,8-dioxo-3,4,12,12a-tetrahidro-2H-pirido[5,6]pirazino[2,6-b][1,3]oxazina-9-carboxamida
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas del dolutegravir en la indicación autorizada han sido adecuadamente contrastadas mediante cinco ensayos clínicos principales (pivotales) de fase 3, tres de ellos controlados con comparadores activos y otros dos abiertos. Dos de los estudios controlados (SPRING-2 y SINGLE) y uno de los abiertos (FLAMINGO) se llevaron a cabo con pacientes no tratados previamente (naïve), mientras que los dos restantes (SAILING, controlado, y VIKING-3, abierto) lo fueron con pacientes insatisfactoriamente tratados anteriormente para la infección por VIH.
Pacientes naïve
El estudio SPRING-2 (ING113086; Raffi, 2013) es un estudio multinacional (Europa, Rusia, Estados Unidos, Canadá y Australia), aleatorizado, doblemente ciego y controlado con un comparador activo, en el que se comparó un régimen antiretroviral conteniendo dolutegravir frente a otro con raltegravir. El estudio fue realizado con 822 pacientes adultos con infección por VIH y con una carga viral sérica ≥ 1.000 copias/ml de ARN de VIH que no habían sido tratados con anterioridad por este motivo; el 86% eran varones, un 85% blancos, con una mediana de edad de 36 años, una carga viral media de 4,55 log10 (35.500) copias/ml y con un 28% de los pacientes con más de 100.000 (5 log10).
Los pacientes recibieron por vía oral dolutegravir (50 mg/24 h) o raltegravir (400 mg/12 h), junto con un tratamiento de base con tenofovir y emtricitabina o de abacavir y lamivudina, a criterio del investigador. Como variable primaria de eficacia se determinó el porcentaje de pacientes con una carga viral inferior a 50 copias/ml (1,7 log10) al final de 96 semanas de tratamiento.
Los resultados mostraron unas tasas del 81% con la combinación de dolutegravir vs. 76% con la de raltegravir, con una diferencia ajustada de 4,5 puntos (IC95% -1,1 a 10,0), mostrando la no inferioridad del dolutegravir con respecto al raltegravir, Se produjo un fallo en la respuesta virológica en el 5% vs. 10% y la mediana del incremento observado en el recuento de linfocitos CD4+ fue de 276 células/mm3 vs. 264.
El estudio SINGLE (ING114467; Walmsley, 2013) es un estudio multinacional (Europa, Estados Unidos, Canadá y Australia), aleatorizado, doblemente ciego y controlado con comparador activo, en el que se comparó un régimen antiretroviral conteniendo dolutegravir frente a efavirenz/tenofovir/emtricitabina. El estudio fue realizado con 833 pacientes adultos con infección por VIH y con una carga viral sérica ≥ 1.000 copias/ml de ARN de VIH que no habían sido tratados con anterioridad; el 84% eran varones, un 68% blancos (y un 24% negros), con una mediana de edad de 35 años, una carga viral media de 4,55 log10 (35.500) copias/ml y con un 32% de los pacientes con más de 100.000 (5 log10). Los pacientes recibieron por vía oral dolutegravir (50 mg/24 h) junto con abacavir y lamivudina, o un comprimido conteniendo efavirenz, tenofovir y emtricitabina.
Los resultados a las 48 semanas de tratamiento mostraron unas tasas del 88% con la combinación de dolutegravir vs. 81% con efavirenz/tenofovir/emtricitabina, con una diferencia ajustada de 7,4 puntos (IC95% 2,5 a 12,3), mostrando la superioridad del régimen de dolutegravir. Estas diferencias fueron de 83 vs. 76% en los pacientes con carga viral inicial mayor de 100.000 copias (5 log10) y de 90 vs 85% en aquellos con ≤ 100.000 copias/ml. La mediana de tiempo transcurrido hasta la supresión viral fue de 28 vs. 84 días (p< 0,001) y el aumento del recuento de linfocitos CD4+ fue de 267 vs. 208 (p< 0,001).
El estudio FLAMINGO (Clotet, 2014) es un estudio abierto, multinacional, en el que se comparó dolutegravir (50 mg/24 h) frente a darunavir/ritonavir (800/100 mg/24 h), junto con un tratamiento de base con tenofovir y emtricitabina o de abacavir y lamivudina, a criterio del investigador. El estudio fue realizado con 484 pacientes adultos con infección por VIH y con una carga viral sérica ≥ 1.000 copias/ml de ARN de VIH que no habían sido tratados con anterioridad. Los resultados a las 48 semanas de tratamiento mostraron unas tasas del 90% con la combinación de dolutegravir vs. 83% con la de darunavir/ritonavir, con una diferencia ajustada de 7,1 puntos (IC95% 0,9 a 13,2; p= 0,025), mostrando la superioridad del régimen de dolutegravir.
Pacientes con fracasos antirretrovirales previos, pero no tratados con inhibidores de integrasa
El estudio SAILING (ING111762; Cahn, 2013) es un estudio multinacional, aleatorizado, doblemente ciego y controlado con un comparador activo, en el que se comparó un régimen antiretroviral conteniendo dolutegravir frente a otro con raltegravir. El estudio fue realizado con 715 pacientes adultos con infección por VIH y con una carga viral sérica ≥ 400 copias/ml de ARN de VIH que habían sido tratados con antirretrovirales pero no de la clase de los inhibidores de integrasa; el 68% eran varones, un 50% blancos, con una mediana de edad de 43 años y un 16% coinfectados con hepatitis C.
Los pacientes recibieron por vía oral dolutegravir (50 mg/24 h) o raltegravir (400 mg/12 h), junto con un tratamiento de base con tenofovir y emtricitabina o de abacavir y lamivudina, a criterio del investigador. Los resultados mostraron unas tasas del 71% con la combinación de dolutegravir vs. 64% con la de raltegravir, con una diferencia ajustada de 7,4 puntos (IC95% 0,7 a 14,2; p= 0,03), mostrando la superioridad del dolutegravir sobre raltegravir. Estas diferencias fueron de 62 vs. 47% en los pacientes con carga viral inicial mayor de 50.000 copias (4,7 log10) y de 75 vs 71% en aquellos con ≤ 50.000 copias/ml. Se produjo un fallo en la respuesta virológica en el 1,1% vs. 4,7 %, con una diferencia ajustada de -3,7 puntos (IC95% -6,1 a -1,2; p= 0,003).
Pacientes con fracasos antirretrovirales previos incluyendo inhibidores de integrasa
El estudio VIKING-3 (ING112574; Castagna, 2014) es un estudio multinacional, abierto, de un único brazo de tratamiento, en el que se estudió un régimen antiretroviral conteniendo dolutegravir en pacientes insatisfactoriamente tratados con combinaciones incluyendo a otros inhibidores de la integrasa. El estudio fue realizado con 183 pacientes adultos con infección por VIH y evidencia genotípica de reistencia a raltegravir y/o elvitegravir, y con una carga viral sérica ≥ 500 copias/ml; el 77% eran varones y con una mediana de edad de 48 años.
Los pacientes recibieron por vía oral dolutegravir (50 mg/12 h) junto con un tratamiento de base previo, excluyendo al raltegravir o elvitegravir. Los resultados mostraron una variación de la carga viral el 8º día del tratamiento de -1,43 log10 (IC95% -1,3 a -1,5; p= 0,03); un 69% de los pacientes redujeron su carga viral a menos de 50 copias/ml a las 24 semanas de tratamiento.
Seguridad
Los eventos adversos más comúnmente descritos en los estudios clínicos controlados con la combinación de dolutegravir con otros antirretrovirales fueron diarrea (16%), náuseas (15%) y cefalea (14%), sin diferencias sustanciales con relación a la terapia de base. El porcentaje de pacientes que suspendieron el tratamiento por la aparición de eventos adversos fue del 2%, frente a un 2-4% con raltegravir y 10% con efavirenz.
ASPECTOS INNOVADORES
Dolutegravir es un agente antiviral directo que actúa inhibiendo la integrasa del VIH, un enzima codificado por el virus que facilita la integración (inserción) del genoma del VIH en el genoma de la célula huésped (linfocitos T). Está relacionado química y farmacológicamente con raltegravir y elvitegravir, previamente registrados. Ha sido autorizado para el tratamiento de adultos y adolescentes mayores de 12 años infectados por el Virus de Inmunodeficiencia Humana (VIH), en combinación con otros medicamentos antirretrovirales.
Los datos clínicos disponibles proceden de amplios y rigurosos ensayos clínicos, confirmando que las combinaciones con dolutegravir no son inferiores a las de raltegravir y elvitegravir en cuanto a eficacia virológica y clínica, y son superiores al efavirenz/tenofovir/emtricitabina y a las combinaciones incluyendo darunavir/ritonavir, en pacientes no tratados previamente. En cuanto a aquellos insatisfactoriamente tratados anteriormente, los que no había recibido un inhibidor de la integrasa, el dolutegravir fue superior estadísticamente al raltegavir, e incluso mostró una notable respuesta virológica (69%) en pacientes insatisfactoriamente tratados con combinaciones incluyendo raltegravir o elvitegravir.
Desde el punto de vista de la seguridad, el dolutegravir presenta un perfil aceptable, con una baja tasa de suspensiones del tratamiento por motivos toxicológicos. Los eventos más comunes son náuseas, diarrea y cefalea.
Un amplio meta-análisis (Messiaen, 2013) ha venido a concluir que la incorporación de fármacos de la clase de los inhibidores de la integrasa como tratamiento de primera línea de la infección por VIH da lugar a mejores resultados que otros grupos ya establecidos en la terapéutica, como los inhibidores de la proteasa (indinavir, etc.). Sin embargo, la aparición de la resistencia a los primeros inhibidores de la integrasa (raltegravir y elvitegravir) ha sido relativamente rápida. En particular, la mutación Q148R y otras mutaciones Q148 aparecen en el 40% en los VIH aislados de pacientes con fracaso virológico con raltegravir.
Por el contrario, el dolutegravir presenta una elevada barrera frente a las mutaciones del VIH en pacientes previamente no tratados con esta clase de antirretrovirales. Por ello, cuando se usa como parte de un tratamiento de primera línea, el dolutegravir es uno de los pocos antirretrovirales que no parecen producir mutaciones clínicamente relevantes. Esta mayor capacidad frente a las mutaciones responsables de la resistencia del VIH parece que podría deberse a la mayor duración e intensidad del bloqueo de la integrasa, así como por la mayor limitación de la capacidad de replicación de las cepas de VIH que podrían hacerse resistentes al dolutegavir (Mesplede, 2014). Sin duda, el dolutegravir supone una cierta evolución en el relativamente reciente grupo de los inhibidores de la integrasa del VIH.
Además, su perfil farmacocinético es más favorable que el de sus antecesores de este grupo, con una semivida celular prolongada que facilita una única administración diaria, sin necesidad de bloqueantes enzimáticos adicionales (como el cobicistat, en el caso del elvitegravir) y además es metabolizado mayoritariamente por una vía ajena a los isoenzimas del citocromo p4501, lo que limita notablemente el número y la relevancia de las interacciones con otros fármacos, incluyendo la mayoría de los antirretrovirales (Fantauzzi, 2014). Todo ello, unido a la utilidad en pacientes que previamente habían fracasado con raltegravir o elvitegravir, le aporta un significativo valor añadido y viene a consolidar la relevancia de los inhibidores de la integrasa como fármacos de primera consideración en el tratamiento de la infección por VIH.
|
VALORACIÓN |
|
|---|---|
|
Dolutegravir ► TIVICAY® (GlaxoSmithKline) |
|
|
Grupo Terapéutico (ATC): JO5AX. TERAPIA ANTIINFECCIOSA SISTÉMICA. Antivirales de acción directa: otros |
|
|
Indicaciones autorizadas: Tratamiento de adultos y adolescentes mayores de 12 años infectados por el Virus de Inmunodeficiencia Humana (VIH), en combinación con otros medicamentos antirretrovirales. |
|
|
Valoración global: INNOVACIÓN MODERADA. Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar. |
♣ ♣ |
|
Novedad clínica: Posibilidad de asociar con otros tratamientos actualmente en vigor, utilidad en cuadros refractarios a los tratamientos actuales o en pacientes en los que el tratamiento estándar está contraindicado. |
⇑ |
|
Novedad físico-química: Mejora las características farmacocinéticas, con incidencia en las condiciones de uso. |
⇑ |
|
FÁRMACOS RELACIONADOS REGISTRADOS ANTERIORMENTE EN ESPAÑA* |
|||
|---|---|---|---|
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Raltegravir |
Isentress |
MerckSharpDohme |
2008 |
|
Elvitegravir |
Stribild** |
Gilead |
2013 |
|
Dolutegravir |
Tivicay |
GlaxoSmithKline |
2014 |
* Se indican únicamente los primeros registros autorizados con ese principio activo.
** Asociado a cobicistat, emtricitabina y tenofovir.
Bibliografía
Bibliografía
- Cahn P, Pozniak AL, Mingrone H, Shuldyakov A, Brites C, Andrade-Villanueva JF, Richmond G, Buendia CB, Fourie J, Ramgopal M, Hagins D, Felizarta F, Madruga J, Reuter T, Newman T, Small CB, Lombaard J, Grinsztejn B, Dorey D, Underwood M, Griffith S, Min S; extended SAILING Study Team. Dolutegravir versus raltegravir in antiretroviral-experienced, integrase-inhibitor-naive adults with HIV: week 48 results from the randomised, double-blind, non-inferiority SAILING study. Lancet. 2013; 382(9893): 700-8. doi: 10.1016/S0140-6736(13)61221-0.
- Castagna A, Maggiolo F, Penco G, Wright D, Mills A, Grossberg R, Molina JM, Chas J, Durant J, Moreno S, Doroana M, Ait-Khaled M, Huang J, Min S, Song I, Vavro C, Nichols G, Yeo JM; VIKING-3 Study Group. Dolutegravir in antiretroviral-experienced patients with raltegravir- and/or elvitegravir-resistant HIV-1: 24-week results of the phase III VIKING-3 study. J Infect Dis. 2014; 210(3): 354-62. doi: 10.1093/infdis/jiu051.
- Clotet B, Feinberg J, van Lunzen J, Khuong-Josses MA, Antinori A, Dumitru I, Pokrovskiy V, Fehr J, Ortiz R, Saag M, Harris J, Brennan C, Fujiwara T, Min S; ING114915 Study Team. Once-daily dolutegravir versus darunavir plus ritonavir in antiretroviral-naïve adults with HIV-1 infection (FLAMINGO): 48 week results from the randomised open-label phase 3b study. Lancet. 2014; 383(9936): 2222-31. doi: 10.1016/S0140-6736(14)60084-2.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cuéllar S. Elvitegravir, cobicistat, emtricitabina, tenofovir (Stribild) en infección por VIH. Panorama Actual Med. 2014; 38(370): 39-48.
- European Medicines Agency (EMA). Tivicay®. European Public Assessment Report (EPAR). EMA/733654/2013; EMEA/H/C/002753. http://www.ema.europa.eu/. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002753/WC500160683.pdf
- Fantauzzi A, Mezzaroma I. Dolutegravir: clinical efficacy and role in HIV therapy. Ther Adv Chronic Dis. 2014; 5(4): 164-77. doi: 10.1177/2040622314530461.
- Mesplède T, Wainberg MA. Is Resistance to Dolutegravir Possible When This Drug Is Used in First-Line Therapy? Viruses. 2014; 6(9): 3377-3385.
- Messiaen P, Wensing AM, Fun A, Nijhuis M, Brusselaers N, Vandekerckhove L. Clinical use of HIV integrase inhibitors: a systematic review and meta-analysis. PLoS One. 2013; 8(1): e52562. doi: 10.1371/journal.pone.0052562.
- Raffi F, Jaeger H, Quiros-Roldan E, Albrecht H, Belonosova E, Gatell JM, Baril JG, Domingo P, Brennan C, Almond S, Min S; extended SPRING-2 Study Group. Once-daily dolutegravir versus twice-daily raltegravir in antiretroviral-naïve adults with HIV-1 infection (SPRING-2 study): 96 week results from a randomised, double-blind, non-inferiority trial. Lancet Infect Dis. 2013; 13(11): 927-35. doi: 10.1016/S1473-3099(13)70257-3.
- Walmsley SL, Antela A, Clumeck N, Duiculescu D, Eberhard A, Gutiérrez F, Hocqueloux L, Maggiolo F, Sandkovsky U, Granier C, Pappa K, Wynne B, Min S, Nichols G; SINGLE Investigators. Dolutegravir plus abacavir-lamivudine for the treatment of HIV-1 infection. N Engl J Med. 2013; 369(19): 1807-18. doi: 10.1056/NEJMoa1215541.
1 El dolutegravir es metabolizado mayoritariamente mediante la vía de la UDP-glucuronil transferasa 1A1.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares




