Decitabina DACOGEN® (Janssen Cilag)
 Nº377
Nº377
LEUCEMIA MIELOIDE AGUDA (LMA)
La leucemia mieloide aguda como una proliferación neoplásica de células inmaduras de estirpe mieloide que proceden de un progenitor hematopoyético lesionado con capacidad de maduración alterada y que, debido a su expansión, desplaza a las células normales de la médula ósea. Se trata del tipo más común de leucemia aguda en adultos y representa un 40% de las leucemias en el mundo occidental. En la Unión Europea cada año se diagnostican alrededor de 18.000 casos, con una mediana de edad en el momento del diagnóstico entre 64 y 67 años.
La decitabina es un agente antitumoral de tipo antimetabolito (es un análogo de la citidina), estructural y farmacológicamente relacionado con la azacitidina; ha sido autorizado para el tratamiento de pacientes adultos de 65 o más años de edad con diagnóstico reciente de leucemia mieloide aguda (LMA) de novo o secundaria, según la clasificación de la Organización Mundial de la Salud (OMS), que no son candidatos a quimioterapia de inducción convencional. Dada la muy baja prevalencia de esta condición, el medicamento ha sido designado como huérfano.
El único ensayo clínico de fase III (confirmatorio de eficacia y seguridad) disponible, comparativo con citarabina en bajas dosis, ha mostrado consistentemente una mayor eficacia en términos de supervivencia global, con una mejora de 2,7 meses, así como en otras variables clínicamente significativas. Dichas diferencias favorables a la decitabina en relación a la citarabina son consideradas como clínicamente relevantes, habida cuenta de que los pacientes sobre los que se utilizaron ambas eran de alto riesgo (un 40% tenían ≥75 años). Por otro lado, su perfil toxicológico hace que sea relativamente bien tolerado, aunque con las obvias manifestaciones hematológicas adversas (trombocitopenia, anemia, neutropenia, etc.).
La médula ósea produce inicialmente células madre sanguíneas indiferenciadas o pluripotenciales que, posteriormente, se transforman en células sanguíneas maduras, tanto de tipo mieloide como linfoide. Mientras que las células linfoides inmaduras acaban produciendo diferentes estirpes de linfocitos, las mieloides se pueden transformar en eritrocitos, ciertos leucocitos y megacariocitos (precursores de las plaquetas).
La leucemia puede ser aguda, progresando rápidamente y con muchas células inmaduras neoplásicas, o crónica, que progresa lentamente con células leucémicas de apariencia más madura. Las leucemias agudas son cuadros neoplásicos específicos de células hemopoyéticas de tipo pluripotencial; es decir, se trata de diferentes formas de expansión de un clon maligno específico de células sanguíneas. Se pueden clasificar en dos grandes grupos: las leucemias linfoides agudas (LLA) y las leucemias mieloides agudas (LMA), también conocidas, por contraposición a las anteriores, como leucemias no linfoides agudas (LNLA).
En el caso de la leucemia mieloide aguda, habitualmente las células madre mieloides se transforman en un tipo de glóbulo blanco inmaduro (mieloblasto o blastocito mieloide) y anómalo que no se transforman en glóbulos blancos sanos. En otras formas de LMA, se produce un excesivo número de células madre que se transforman en glóbulos rojos o plaquetas anormales o leucémicos, que acaban desplazando de la médula ósea y de la sangre a sus congéneres sanos, provocando infecciones, anemia o hemorragias graves. Además, las células leucémicas se pueden diseminar fuera del torrente sanguíneo y de los órganos hematopoyéticos a otras partes del organismo, particularmente al sistema nervioso central (cerebro y médula espinal), piel y encías.
Así pues, se puede definir a la leucemia mieloide aguda como una proliferación neoplásica de células inmaduras de estirpe mieloide que proceden de un progenitor hematopoyético lesionado con capacidad de maduración alterada y que, debido a su expansión, desplaza a las células normales de la médula ósea. La LMA se conoce también como leucemia mielógena aguda, leucemia mieloblástica aguda, leucemia granulocítica aguda o leucemia no linfocítica aguda.
La LMA es el tipo más común de leucemia aguda en adultos y representa un 40% de las leucemias en el mundo occidental. En la Unión Europea cada año se diagnostican alrededor de 18.000 casos, con una mediana de edad en el momento del diagnóstico entre 64 y 67 años. En Estados Unidos se registran 14.500 casos anualmente, mayoritariamente en personas de más de 60 años; de hecho, un tercio tiene más de 75 años (Malik, 2014). Su incidencia en este país es de 0,59:100.000 en menores de 20 años, pero asciende a 1,54 entre los 20 y los 49, a 5,02 entre los 50 y 64, a 14,80 entre los 65 y 74 y 24,40 a partir de los 75 (SEER, 2014).
Entre los posibles factores de riesgo de LMA están el ser varón (proporción 1,3:1 frente a mujeres), fumar (especialmente después de los 60 años), haber recibido un tratamiento con quimioterapia (un 10-20% de todos los casos) o radioterapia en el pasado, haber padecido leucemia linfoblástica aguda (LLA) infantil en el pasado, estar expuesto a la radiactividad o al benceno y tener antecedentes de trastornos hematológicos proliferativos, como el síndrome mielodisplásico. Por otro lado, el riesgo de desarrollar LMA es tres veces mayor entre personas con parentesco en primer grado de pacientes.
El inicio de la enfermedad es relativamente rápido y raramente se superan los tres meses entre la aparición de los primeros síntomas y el diagnóstico de la LMA. Los síntomas son consecuencia de la anemia producida por el déficit de glóbulos rojos (cansancio, mareos, palidez), de plaquetas (hematomas, sangrado de encías, nariz u otras mucosas) y de granulocitos (fiebre e infecciones). En ocasiones puede observarse el crecimiento de los ganglios linfáticos, así como hepato y/o esplenomegalia. Puedes observarse síntomas neurológicos, que denotan una infiltración del sistema nervioso central (dolor de cabeza, vómitos, somnolencia, etc.), aunque también pueden afectar a piel (nódulos diseminados o zonas de piel engrosada), mucosas (inflamación de las encías), ocular (visión borrosa, ceguera), etc.
El origen de la leucemia mieloide aguda (LMA) está en el proceso de malignificación de algún clon de mieloblasto, como consecuencia de la acumulación de una serie de mutaciones en su ADN, lo que le impide proseguir en su proceso de diferenciación celular normal, por lo que queda en un estado más o menos indiferenciado (inmaduro); cuando a ello se le agregan otras mutaciones que le confieren la capacidad para proliferar rápidamente, se produce una multiplicación incontrolada del clon que acaba por arrinconar literalmente a las células sanguíneas normales de la médula ósea y del torrente circulatorio, desencadenante los síntomas de la enfermedad.
La gran diversidad y heterogeneidad de tipos celulares que pueden observarse en la LMA se debe a que la transformación leucémica puede ocurrir en diferentes estadios a lo largo del proceso de diferenciación, lo que condiciona el tipo de células cancerígenas que se podrán encontrar en un determinado paciente. Esto es determinante para su clasificación y pronóstico. Las anomalías cromosómicas consisten básicamente en translocaciones (t) e inversiones (inv) de trozos de cromosomas, que provocan la formación nuevo material genético susceptible de generar nuevas proteínas de fusión que pueden perder su función original o ejercerla pero de forma incontrolada, escapando a los sistemas de regulación de la expresión génica. En el caso de que estas estas proteínas anómalas actúen como factores de transcripción, se produce una interrupción de la diferenciación y la posterior proliferación incontrolada. La OMS ha establecido (2008) la siguiente clasificación:
- Leucemia mieloide aguda (LMA) con anomalías genéticas recurrentes
- LMA con t(8;21)(q22;q22); RUNX1-RUNX1T1
- LMA con inv(16)(p13.1q22) o t(16;16)(p13.1;q22); CBFB-MYH11
- LMA con t(9;11)(p22;q23); MLLT3 MLL
- LMA con t(6;9)(p23;q34); DEK-NUP214
- LMA con inv(3)(q21q26.2) o t(3;3)(q21;q26.2); RPN1-EVI1
- LMA (megacarioblástica) con t(1;22)(p13;q13); RBM15-MKL1
- Leucemia promielocítica aguda (LPA) con t(15;17)(q22;q12); PML-RARA
- LMA con mutación NPM1
- LMA con mutación CEBPA
- LMA con mielodisplasia
- Neoplasias mieloides relacionadas con el tratamiento
- LMA sin otra especificación (NOS)
- LMA con diferenciación mínima
- LMA sin maduración
- LMA con maduración
- Leucemia mielomonocítica aguda
- Leucemia aguda monoblástica/monocítica
- Leucemia eritroide aguda
- Leucemia eritroide pura
- Eritroleucemia, eritroide/mieloide
- Leucemia aguda megacarioblástica
- Leucemia aguda basófila
- Panmielosis aguda con mielofibrosis (mielofibrosis aguda, mieloesclerosis aguda)
- Sarcoma mieloide (tumor mieloide extramedular, sarcoma granulocítico, cloroma)
- Proliferaciones mieloides relacionadas con el síndrome de Down
- Mielopoyesis transitoria anormal (trastorno mieloproliferativo transitorio)
- Leucemia mieloide asociada con síndrome de Down
- Neoplasias de células dendríticas plasmocitoides
- Leucemias agudas de linaje ambiguo
- Leucemia aguda indiferenciada
- Leucemia aguda fenotipo mezclado con t(9;22)(q34;q11.2); BCR-ABL1
- Leucemia aguda fenotipo mezclado con t(v;11q23); MLL reordenado
- Leucemias agudas de fenotipo mixto, B/mieloide, NOS
- Leucemias agudas de fenotipo mixto, T/mieloide, NOS
- Entidad provisional: natural killer (NK) de células de leucemia linfoblástica/linfoma
El tratamiento de la leucemia mieloide aguda en adultos habitualmente tiene dos fases.
- Terapia de inducción de la remisión: Tiene como objetivo destruir las células leucémicas en la sangre y en la médula ósea. Esto induce la remisión de la leucemia.
- Terapia de posremisión (continuación de la remisión): Comienza después de que la leucemia está en remisión. Su objetivo es destruir cualquier célula leucémica aislada que quede, que tal vez no esté activa pero que pueda comenzar a volver a crecer y producir una recaída.
En general, y salvo los casos de leucemia promielocítica aguda, los tratamientos requeridos para inducir la remisión de la LMA son muy agresivos, lo que les contraindica en caso de edad avanzada o en caso de graves patologías concomitantes. De hecho el 70% de los pacientes mayores de 65 años no reciben tratamiento intensivo y su supervivencia es de dos meses. En estos casos, las opciones terapéuticas son escasas y con resultados insatisfactorios. Las actuales guías clínicas recomiendan tratamiento de soporte (no intensivo) con hidroxiurea y transfusiones sanguíneas, o tratamiento activo sistémico con citarabina a dosis bajas, o agentes hipometilantes como la azacitidina y la decitabina (AEMPS, 2014).
Pacientes hasta 60 años
Se utiliza como tratamiento de inducción el esquema 3 + 7, que consiste en administrar 3 días de antraciclinas (daunorubicina, idarubicina o mitoxantrona) y 7 días con citarabina, sigue siendo en la actualidad el estándar para el tratamiento de inducción. Con dicho esquema se logra la respuesta completa en el 60-80% de los adultos jóvenes. Ninguna otra intervención ha demostrado de manera convincente ser mejor. La quimioterapia de inducción se debe iniciar después de que el trabajo de diagnóstico se ha completado, con la mínima demora. Los datos retrospectivos indican que el resultado del tratamiento puede verse afectado cuando el tiempo desde el diagnóstico hasta el inicio del tratamiento aumenta más allá de 5 días (Novelli, 2011).
Existen varias estrategias posremisión:
- Tratamiento intensivo: cuatro ciclos de altas dosis de citarabina (HiDAC): 3 g/m2 cada 12 horas los días 1, 3 y 5 de cada mes.
- Tratamiento de mantenimiento: sin beneficio en cuanto a la duración de la remisión o la supervivencia global a los 3 años con el mantenimiento intensivo en comparación con el trasplante hematopoyético como terapia posterior a la remisión. Sí parece ser superior a la consolidación con HiDAC secuencial y mitoxantrona (HiDAC 1 g/m2 cada 12 horas los días 1, 2, 8 y 9; mitoxantrona 10 mg/m2 en los días 3, 4, 10 y 11). La quimioterapia de mantenimiento generalmente no se administra sistemáticamente fuera de ensayos clínicos para los pacientes con LMA (no promielocítica).
- TASPE (trasplante autólogo de progenitores hematopoyéticos de sangre periférica): es considerado como una opción alternativa para pacientes con una citogenética favorable y riesgo intermedio, mientras que no puede ser recomendado en pacientes con alto riesgo. El resultado después del TASPE es al menos tan bueno como la quimioterapia posremisión; hasta la fecha no ha habido ninguna evidencia de una mejora en los resultados.
- Alo-TPH (trasplante alogénico de progenitores hematopoyéticos): se asocia con menores tasas de recaída. Este beneficio es atribuible tanto a la terapia con altas dosis de los regímenes de acondicionamiento estándar como a un potente efecto injerto contra leucemia (graft versus leukemia, GVL). Sin embargo, los beneficios del alo-TPH se han visto limitados por una mortalidad relacionada con el trasplante. Se suele practicar en pacientes con LMA con pronóstico desfavorable y en aquéllos refractarios.
Pacientes de 60 a 75 años
El aumento de la edad se asocia con factores predictivos de muerte prematura, comorbilidades diversas (diabetes, hipertensión arterial, cardiopatía, etc.) y a la resistencia al tratamiento más frecuentemente observada en LMA con citogenética adversa y en LMA secundarias. Independientemente de estas asociaciones, la edad sigue siendo un importante predictor de mal pronóstico. Los estudios sugieren que la quimioterapia de inducción de remisión proporciona una mejor calidad de vida y una mayor supervivencia que sólo el tratamiento de soporte.
Para los pacientes con una puntuación en la escala ECOG (Eastern Cooperative Oncology Group) menor de 2, la terapia estándar de inducción de la remisión es a menudo una opción plausible que resulta en tasas de remisión del 50%. La elección de la antraciclina (daunorubicina, idarubicina o mitoxantrona) es de poca importancia, partiendo de dosis de toxicidad equivalentes; además, en casos individuales puede considerarse la reducción de la dosis. El grado de respuesta de la terapia de inducción estándar depende en gran medida de la citogenética, ya que una citogenética adversa es un fuerte factor pronóstico independiente del fracaso para alcanzar una respuesta completa. Para este subgrupo de pacientes de mayor edad, las tasas de respuesta completa son del 30% o menos y la supervivencia global es menor del 5%.
Como terapia de posremisión, no parece haber diferencias entre la utilización de dos ciclos de quimioterapia relativamente intensiva (citarabina 500 mg/m2 cada 12 horas con mitoxantrona 5 mg/m2 cada 12 horas por 6 dosis) con ciclos menos intensivos (citarabina 100 mg/m2, días 1-5). Para los pacientes sin citogenética adversa, buen estado general y sin comorbilidades significativas el estándar es el 3 + 7 de inducción seguido de ciclos repetitivos de consolidación de dosis quimioterápica de intensidad moderada (Novelli, 2011).
Finalmente, el alo-TPH (trasplante alogénico de progenitores hematopoyéticos) en pacientes de edad avanzada se ha convertido en un campo activo y prometedor de investigación. En particular, los trasplantes de intensidad reducida (TIR) o minialotrasplantes se han desarrollado para reducir la mortalidad asociada al trasplante en los pacientes ancianos o en aquéllos más jóvenes pero con comorbilidades.
Pacientes mayores de 75 años
El empleo de dosis bajas de citarabina (20 mg SC, 2 veces al día, durante 10 días) se asocia con una mayor supervivencia que con la hidroxiurea, aunque solo marginalmente.
ACCIÓN Y MECANISMO
La decitabina es un agente antitumoral de tipo antimetabolito (es un análogo de la citidina), autorizado para el tratamiento de pacientes adultos de 65 o más años de edad con diagnóstico reciente de leucemia mieloide aguda (LMA) de novo o secundaria, según la clasificación de la Organización Mundial de la Salud (OMS), que no son candidatos a quimioterapia de inducción convencional.
Las células indiferenciadas de la leucemia mieloide aguda se caracterizan por presentar intensos procesos de metilación del ADN, que se relacionan con el control de la expresión genética. Una vez en el interior de la célula, la decitabina es fosforilada mediante el enzima desoxicitidina cinasa hasta producir el derivado trifosfatado, el cual compite con la citosina, reemplazándola, en la pareja CpG (citosina-guanosina dinucleótido) del ADN. Una vez intercalada en la cadena de ADN, se une de forma estable (mediante un enlace covalente) al enzima ADN metiltransferasa (DNMT, DNA methyltransferase), la cual queda bloqueada y no es capaz de catalizar las reacciones de metilación (incorporación de grupos metilo: -CH3) a las bases nucleicas de varios genes promotores; como consecuencia de la reducción de la capacidad metiladora, algunos de los genes silenciados por las mutaciones propias de la leucemia mieloide – incluyendo a varios genes supresores tumorales: p15/INK4b, p16, p14, SHP-1, p21WAF1, p73, C/EBPd – vuelven a expresarse y, con ello, pueden prevenir la transformación tumoral de las células hematopoyéticas precursoras e inducir su diferenciación normal. Asimismo, la decitabina puede facilitar también la recuperación de la expresión de genes implicados en la inmunogenicidad y en el reconocimiento inmune – antes suprimidos – de las células tumorales.
El efecto inactivante del enzima DNMT no solo parece ser debido a su unión covalente con el ADN, previniendo su síntesis, sino que también podría facilitar la degradación de aquella ya sintetizada, al potenciar los procesos de ubiquitinación y degradación del enzima en el proteasoma.
Sin embargo, la decitabinina es capaz de ejercer efectos citotóxicos no relacionados con una reducción de la metilación de los genes supresores tumorales y e inmunológicos, sino que también puede dar lugar a la formación de complejos – aductos – de DNMT y el ADN que interfieren con la síntesis de nuevo ADN durante la división celular, poniendo en marcha los mecanismos de apoptosis (muerte celular programada). En este sentido, parece que la inducción de la apoptosis celular por decitabina estaría ligada a la recuperación de la expresión del gen supresor tumoral p73.
Finalmente, según se ha constatado en diversos modelos tumorales experimentales en animales, la decitabina también ejerce un efecto antiangiogénico, reduciendo la formación de vasos sanguíneos en el interior tumoral.
ASPECTOS MOLECULARES
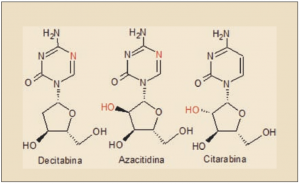
Se trata de un análogo molecular de la base nucleica citidina, de núcleo pirimidínico. La decitabina está estrechamente relacionada estructural y farmacológicamente con otros antimetabolitos citotóxicos análogos de la citidina, como citarabina, gemcitabina, capecitabina y, en particular, con la azacitidina. De hecho, en términos químicos, la decitabina es la 4-amino-1-[(2R,4S,5R)-4-hidroxi-5-(hidroximetil)oxolan-2-il]-1,3,5-triazin-2-ona2-desoxiazacitidina, es decir, la 2-desoxiazacitidina.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas han sido adecuadamente contrastadas mediante un ensayo clínico de fase III multinacional (15 países), abierto y aleatorizado (DACO-016; Kantarjian, 2012), en el que se comparó la administración de dacitabina (20 mg/m2, infusión IV en 1 h cada 24 h) durante los 5 primeros días de cada ciclo de 4 semanas, frente a citarabina en dosis bajas (20 mg/m2, subcutánea cada 24 h) durante los 10 primeros días de cada ciclo de 4 semanas, en un conjunto de 485 pacientes con leucemia mieloide aguda primaria (64%) o secundaria (34%), que fueron valorados como de alto riesgo global, aunque con riesgo citogenético bajo (36%) o intermedio (64%); la proporción mediana de elementos blásticos en médula era del 46% (un 43% de los pacientes tenían ≥50%). La mediana de edad de los pacientes era de 73 años (un 40% tenían ≥75 años) y un 59% eran varones. El tratamiento se mantuvo hasta la muerte del paciente o la pérdida del beneficio clínico (progresión).
Como variable primaria de eficacia se utilizó la mediana de la supervivencia global (periodo desde el inicio del tratamiento hasta la muerte del paciente, con independencia de su causa); como variable secundaria se determinó la suma de las tasas de remisión completa morfológica y de remisión completa sin recuperación de plaquetas (CR+CRp). Como las variables terciarias se calcularon la remisión completa citogenética (CRt; sobre pacientes con anomalías citogenéticas previas), la supervivencia libre de eventos adversos, la supervivencia libre de enfermedad y la supervivencia libre de recaídas (para pacientes con respuesta CR).
Los resultados mostraron que la supervivencia global fue de 7,7 (IC95% 6,2 a 9,2) meses con dacitabina vs. 5,0 (IC95% 4,7 a 6,3) meses con citarabina, con una reducción del 18% en la tasa de riesgo de muerte en el grupo de la decitabina (HR= 0,82; IC95% 0,68 a 0,99; p= 0,0373)1. Asimismo, excluyendo a los pacientes que habían recibido terapia antileucémica adicional (38% en el grupor de dacitabina y 44% en el de citarabina), la mediana de la supervivencia global fue de 8,5 vs. 5,3 meses (p= 0,044)
En cuanto al resto de variables, las tasas de remisión completa CR+CRp fueron del 17,8% con dacitabina vs. 7,8% con citarabina, siendo la probabilidad 2,5 veces mayor con dacitabina (odds ratio, OR= 2,5; IC95% 1,40 a 4,78; p= 0,0011); asimismo, las tasas de remisión completa citogenética (CRc) fueron del 10,0% vs. 7,3%. En cuanto a las medianas de supervivencia libre de eventos fueron 3,5 meses (IC95% 2,5 a 4,1) vs. 2,1 (IC95% 1,9 a 2,8), de supervivencia libre de enfermedad 3,7 meses (IC95% 2,7 a 4,6) vs. 2,1 (IC95% 1,9 a 3,1) y de supervivencia libre de recaídas fueron 6,7 (IC95% 2,9 a 13,4) vs. 8,3 (IC95% 4,6 a 11,4).
El perfil de seguridad de la decitabina es similar al de la citarabina en dosis bajas. La toxicidad fundamental fue de tipo hematológico, con una mayor incidencia de trombocitopenia (40 vs. 32%), anemia (34 vs. 25%) y neutropenia (32 vs. 18%) en el grupo tratado con decitabina. Las complicaciones de tipo infeccioso fueron también más comunes con decitabina, con episodios febriles asociados a neutropenia (32 vs. 22%) y neumonía (21 vs. 18%). No obstante, es preciso indicar que los pacientes tratados con decitabina estuvieron expuestos al tratamiento durante más tiempo que aquellos tratados con citarabina (4,4 vs. 2,4 meses), lo que es probable que facilitase un reporte mayor de eventos adversos entre los tratados con decitabina. Por otro lado, la tasa de descontinuación del tratamiento por eventos adversos fue ligeramente inferior con decitabina (6%) que con citarabina (8%).
ASPECTOS INNOVADORES
La decitabina es un agente antitumoral de tipo antimetabolito (es un análogo de la citidina), estructural y farmacológicamente relacionado con la azacitidina; ha sido autorizado para el tratamiento de pacientes adultos de 65 o más años de edad con diagnóstico reciente de leucemia mieloide aguda (LMA) de novo o secundaria, según la clasificación de la Organización Mundial de la Salud (OMS), que no son candidatos a quimioterapia de inducción convencional. Dada la muy baja prevalencia de esta condición, el medicamento ha sido designado como huérfano.
La capacidad de la decitabina para limitar sustancialmente los procesos de metilación del ADN, parece ser determinante para permitir la recuperación de la expresión de ciertos genes supresores tumorales y para dificultar la conversión tumoral de los precursores celulares hematológicos.
El único ensayo clínico de fase III (confirmatorio de eficacia y seguridad) disponible, comparativo con citarabina en bajas dosis, ha mostrado consistentemente una mayor eficacia en términos de supervivencia global, con una mejora de 2,7 meses, así como en otras variables clínicamente significativas. Dichas diferencias favorables a la decitabina en relación a la citarabina son consideradas como clínicamente relevantes, habida cuenta de que los pacientes sobre los que se utilizaron ambas eran de alto riesgo (un 40% tenían ≥75 años). Por otro lado, su perfil toxicológico hace que sea relativamente bien tolerado, aunque con las obvias manifestaciones hematológicas adversas (trombocitopenia, anemia, neutropenia, etc.).
Es difícil establecer el papel de la decitabina en el tratamiento, aunque dada la notable escasez de alternativas existente en los pacientes con peor pronóstico, no cabe duda que supone una opción plenamente válida; asimismo, su perfil toxicológico no excesivamente problemático la convierte en una atractiva alternativa en terapias de combinación con otros agentes antileucémicos (Malik, 2014).
Por otro lado, tal como señala el Informe de Posicionamiento Terapéutico de la AEMPS , los datos no permiten comparar clínicamente a la decitabina con la azacitidina, aunque el nivel de evidencia de la primera es mayor en pacientes mayores de 65 años con leucemia mieloide aguda, tanto primaria como secundaria.
|
VALORACIÓN |
|
|---|---|
|
Decitabina ► DACOGEN® (Janssen Cilag) |
|
|
Grupo Terapéutico (ATC): L01BC. TERAPIA ANTINEOPLÁSICA Y AGENTES INMUNOMODULADORES. Citostáticos: antimetabolitos análogos de la pirimidina. |
|
|
Indicaciones autorizadas: Tratamiento de pacientes adultos de 65 o más años de edad con diagnóstico reciente de leucemia mieloide aguda (LMA) de novo o secundaria, según la clasificación de la Organización Mundial de la Salud (OMS), que no son candidatos a quimioterapia de inducción convencional. |
|
|
Valoración global: INNOVACIÓN IMPORTANTE. Aportación sustancial a la terapéutica estándar. |
♣ ♣ ♣ |
|
Novedad clínica: Mejora la eficacia clínica del tratamiento farmacológico estándar |
⇑ |
|
FÁRMACOS RELACIONADOS REGISTRADOS ANTERIORMENTE EN ESPAÑA* |
|||
|---|---|---|---|
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Fluorouracilo |
Fluoro Uracil |
Meda |
1964 |
|
Tegafur |
Utefos** |
Almirall |
1978 |
|
Citarabina |
Citarabina Pfizer |
Pfizer |
1984 |
|
Gemcitabina |
Gemzar |
Lilly |
1985 |
|
Capecitabina |
Xeloda |
Roche |
2001 |
|
Azacitidina |
Vidaza |
Celgene |
2009 |
|
Decitabina |
Dacogen |
Janssen Cilag |
2014 |
* Se indican únicamente los primeros registros autorizados con ese principio activo.
** Retirado del mercado
Bibliografía
Bibliografía
- AEMPS. Informe de Posicionamiento Terapéutico de Decitabina (Dacogen®). PT-DECITABINA/V1/22072014. http://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-decitabina-GCPT.pdf (7 de agosto de 2014).
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- European Medicines Agency (EMA). Dacogen®. European Public Assessment Report (EPAR). EMA/499966/2012; EMEA/H/C/002221. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002221/WC500133571.pdf
- Kantarjian HM, Thomas XG, Dmoszynska A, Wierzbowska A, Mazur G, Mayer J, Gau JP, Chou WC, Buckstein R, Cermak J, Kuo CY, Oriol A, Ravandi F, Faderl S, Delaunay J, Lysák D, Minden M, Arthur C. Multicenter, randomized, open-label, phase III trial of decitabine versus patient choice, with physician advice, of either supportive care or low-dose cytarabine for the treatment of older patients with newly diagnosed acute myeloid leukemia. J Clin Oncol. 2012; 30(21): 2670-7. doi: 10.1200/JCO.2011.38.9429.
- Malik P, Cashen AF. Decitabine in the treatment of acute myeloid leukemia in elderly patients. Cancer Manag Res. 2014; 6: 53-61. doi: 10
- Novelli Canales S, García Cadenas I. Terapéutica farmacológica de los cánceres hematológicos. En: Terapéutica farmacológica de los trastornos neoplásicos e inmunológicos. Consejo General de Colegios Oficiales de Farmacéuticos. Madrid, 2011; pp. 189-220.
- Surveillance, Epidemiology, and End Results Program (SEER). Age-Adjusted SEER Incidence Rates By Age At Diagnosis/Death Acute Myeloid Leukemia, All Races, Both Sexes 1975-2011 (SEER 9). http://seer.cancer.gov/faststats/selections.php?#Output (consultado en septiembre de 2014).
1 En un análisis intermedio, los valores de supervivencia global fueron idénticos, pero la reducción en la tasa de riesgo de muerte en el grupo de la decitabina solo fue del 15% (HR= 0,85; IC95% 0,69 a 1,04; p= 0,108), no significativa estadísticamente.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares




