Daclatasvir DAKLINZA® (Bristol-Myers Squibb)
 Nº380
Nº380
Resumen
El daclatasvir es un agente antiviral activo frente a virus de la hepatitis C (VHC), que actúa inhibiendo específicamente la proteína NS5A, una proteína con diversas funciones relacionadas con la replicación del VHC y el ensamblaje de los viriones. Ha sido autorizado para el tratamiento, en combinación con otros medicamentos, de la hepatitis C crónica en adultos. Presenta un mecanismo de acción diferente de los fármacos hasta ahora utilizados y su potencia antiviral es, sin duda, muy elevada, actuando – al menos in vitro – sobre todos los genotipos de VHC. No obstante, el daclatasvir tiene una baja barrera de resistencia a las mutaciones para algunos genotipos, particularmente para 1a, 2a, 2b y 3a. Aunque actualmente está siendo objeto de varios ensayos clínicos, los datos clínicos disponibles hasta ahora para el daclatasvir no son equiparables en cantidad ni en diversidad a los de simeprevir y, especialmente, de sofosbuvir; en este sentido, es particularmente relevante la muy escasa experiencia clínica actual en pacientes con cirrosis o enfermedad hepática avanzada.
HEPATITIS C
El virus de la hepatitis C (VHC) se clasifica dentro de la familia Flaviviridae por ser un virus envuelto, de aproximadamente 50 nm de diámetro, con una sola cadena de ARN en sentido positivo (5’-3’), formando parte del género Hepacivirus. Su prevalencia global se estima entre 150 y 180 millones (2-3 % de la población general), con una incidencia anual de 3-4 millones de nuevos casos. En España, la prevalencia de la infección por VHC C se sitúa en torno al 1,2-1,7% de la población general, lo que supone en torno a 800.000 personas infectadas, la mayoría aún sin diagnosticar; más del 50% de los pacientes que han necesitado un trasplante de hígado son pacientes con hepatitis C que han evolucionado a una enfermedad hepática terminal.
Existen varios genotipos del VHC. En Europa y EEUU, el más frecuente es el 1 (70% de los casos), seguido por el 2 y 3 (25%). El 2 (a y b) y 4 (b, c, e y m) son más frecuentes en África del Norte y Central, y el 6p y 2i en Asia. En concreto, en Europa predomina el genotipo 1b, seguido de 2a, 2b, 2c y 3a; por su parte, en Norte América predomina el genotipo 1a, seguido de 1b, 2a, 2b y 3a.
Una vez en el interior del hepatocito, el virus de la hepatitis C (VHC) utiliza la maquinaria celular para replicarse. La expresión del ARN viral conduce a la síntesis de una única proteína (poliproteína) de gran tamaño (3.011 aminoácidos), que requiere de la acción de varias proteasas para dar lugar a las formas activas de las proteínas virales, que incluyen a tres proteínas estructurales (E) y a siete no estructurales (NS). Esta poliproteína (C(F)-E1-E2-p7-NS2-NS3-NS4A-NS4B-NS5A-NS5B) genera al menos diez proteínas maduras al ser procesada por la señal peptidasa del retículo endoplásmico, liberando las proteínas C, E1, E2 y p7 que forman la cápside o núcleo viral (C), la envoltura de la partícula (E1 y E2) y p7 que se parece intervenir en la liberación del genoma al formar canales iónicos en la envoltura viral; la región de las proteínas no estructurales (NS2-NS5B) que participan en la replicación son procesadas por dos enzimas virales: NS2 y NS3 que generan un corte autocatalítico en las regiones NS2-NS3 y NS3-NS4A respectivamente y permiten la formación del complejo proteasa de serina NS3/4A que procesa el resto de la poliproteína viral, provocando la maduración de las proteínas NS4B, NS5A y NS5B con función de polimerasa de ARN dependiente de ARN (NS5B) y de fosfoproteína (NS5A); por el momento, la función de la proteína NS4B no está plenamente comprendida.
Las proteínas NS toman el ARN viral formando un complejo de replicación – sistema replicón – que es asociado a membranas citoplasmáticas modificadas. La capacidad de replicación del VHC es enorme, calculándose en un billón (1012) el número de nuevos virus que son capaces de ser producidos durante un día en una persona infectada.
La proteína NS3 del VHC es una enzima multifuncional ya que presenta en el primer tercio de su estructura una actividad de proteasa de serina y en el resto una función de ARN helicasa DexH/D que revierte el enrollamiento de cadenas dobles de ARN formadas durante la replicación viral. El extremo NS4A es una proteína anfipática de 54 aminoácidos que se asocia no covalentemente con las cadenas A0 y A1 de NS3 y provoca una reorganización en su estructura, optimizando así la actividad de proteasa de NS3; además NS4A promueve la localización del complejo NS3/4A a la membrana del retículo endoplásmico donde es procesada la poliproteína viral.
Por su parte la proteína NS5A es una proteína intensamente fosforilada que, una vez escindida de la poliproteína viral, localiza a las membranas donde se une a la fracción 3’-terminal del ARN viral recién sintetizado y participa en la replicación del genoma viral, en parte a través de interacciones con la ARN polimerasa dependiente del ARN viral (NS5B). Finalmente, la NSB5 es la ARN polimerasa dependiente del ARN viral que desarrolla un papel esencial en la replicación del ARN viral, utilizando la cadena de este última como molde para nuevas cadenas y catalizando el proceso de polimerización de los ribonucleótido-trifosfato (rNTP) durante este proceso de replicación, siendo responsable de producir la hebra de ARN complementaria – ARN(-) – que servirá de molde para fabricar las auténticas hebras de ARN viral – ARN(+) –, que a su vez podrán ser de nuevo replicados y traducidas, o bien empaquetados en las proteínas estructurales para formar nuevas partículas virales de VHC, que son liberadas mediante un proceso de exocitosis.
En el año 2011 se produjo un cambio notable en el panorama terapéutico de la hepatitis C, al comercializarse el boceprevir y el telaprevir – la primera generación de inhibidores selectivos y reversibles de la proteasa NS3 – para el tratamiento de pacientes infectados por VHC de tipo 1, tanto no tratados previamente (naïve) como tratados, en combinación con peginterferón alfa y ribavirina (terapia triple). En estas circunstancias, las tasas de respuesta tanto en pacientes naïve como en pretratados llegaban a doblarse prácticamente (de un 40% a un 70%, en término medio), permitiendo acortar la duración del tratamiento en muchos de los pacientes de 48 a 24 semanas. Sin embargo, boceprevir y telaprevir presentan un perfile toxicológico importante que obliga a suspender el tratamiento en un porcentaje de pacientes netamente superior a los tratados solo con peginterferón alfa y ribavirina, amén de un amplio abanico de interacciones farmacológicas, lo cual, asociado con la propia complejidad del tratamiento, dejaba un amplio margen para la mejora.
Tras esta primera generación de inhibidores de la proteasa del VHC ha llegado una nueva oleada de agentes con propiedades farmacodinámicas, farmacocinéticas y toxicológicas más satisfactorias, que está en la fase final del proceso de autorización o ya la han recibido. Se trata del asunaprevir, inhibidor de la NS3); simeprevir, faldaprevir y vaniprevir, inhibidores duales de NS3 y NS4A; daclatasvir y ledipasvir, de la NS5A; y sofosbuvir y deleobuvir, de la NS5B (Cuéllar, 2014).
ACCIÓN Y MECANISMO
El daclatasvir es un agente antiviral activo frente a virus de la hepatitis C (VHC), que actúa inhibiendo específicamente la proteína NS5A, una proteína con diversas funciones relacionadas con la replicación del VHC y el ensamblaje de los viriones. Ha sido autorizado para el tratamiento, en combinación con otros medicamentos, de la hepatitis C crónica en adultos.
Daclatasvir es el primero de la clase de los inhibidores de NS5A y el inhibidor de VHC más potente hasta ahora conocido. El fármaco se une selectivamente en concentraciones picomolares a la proteína NS5A, alterando su localización subcelular, sus procesos de hiperfosforilación e inhibiendo la síntesis de ARN viral. La proteína NS5A es una proteína intensamente fosforilada que, una vez escindida de la poliproteína viral, localiza a las membranas donde se une a la fracción 3’-terminal del ARN viral recién sintetizado y participa en la replicación del genoma viral, en parte a través de interacciones con la ARN polimerasa dependiente del ARN viral (NS5B).
A pesar de su extraordinaria actividad frente al VHC, que se manifiesta en prácticamente los genotipos virales más comunes (1a, 1b, 2a, 2b, 3a, 4a, 5a y 6a), el daclatasvir tiene una baja barrera de resistencia a las mutaciones para algunos genotipos, particularmente para 1a, 2a, 2b y 3a, mientras que dicha barrera es bastante más elevada para los genotipos 1b, y 4a. El grado de susceptibilidad (expresado como EC501) de las cepas salvajes (no mutadas) oscila entre 0,003 nM (1b) y 0,26 (3a), lo que implica una diferencia de casi 100 veces en potencia antiviral.
La mayoría las mutaciones más resistentes en la NS5A del VHC de genotipo 1a se deben a la sustitución de un solo aminoácido, siendo una de las más peculiares la Q30E (sustitución de glutamina por ácido glutámico en la posición 30), lo que eleva la EC50 a 111 nM, 18.500 veces mayor que en el tipo salvaje (0,006 nM). Otras mutaciones únicas que confieren resistencia a daclatasvir en genotipo 1a son M28T, Q30E, Q30H, Q30R, Q30S, L31M, L31V, Y93C y Y93H, con valores de EC50 entre 1 y 111 nM; algunas mutaciones dobles, como Q30R-L31M y Q30H-Y93H también producen altos niveles de resistencia a al genotipo 1a (EC50 410-868 nM); por el contrario, estas mutaciones – salvo la Q30H-Y93H – no afectan sustancialmente a la sensibilidad al daclatasvir por los VHC de genotipo 1b. La mutación L31M reduce la susceptibilidad al daclatasvir de los genotipos 2a y 2b en 440 y 2.600 veces, respectivamente. La frecuencia de cepas mutadas encontradas en pacientes no tratados previamente oscila entre el 1% y el 7% para el genotipo 1a, llegando al 60% en los genotipos 2.
ASPECTOS MOLECULARES
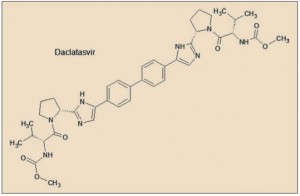
Daclatasvir presenta una característica estructura simétrica, en la que destacan básicamente dos aspectos fundamentales. En primer lugar, el núcleo central de la molécula está formado por un grupo bifenilo ligado por sus dos extremos a sendos anillos imidazólicos, formando los cuatro anillos aromáticos un amplio sistema resonante, de alta densidad electrónica, el cual facilita la unión a la proteína NS5A, estabilizando su estructura y bloqueando sus funciones. En segundo lugar, se aprecian sendas estructuras en los extremos de la molécula que emulan secuencias peptídicas (son, en realidad, carbamatos), que facilitan la inserción del fármaco en los huecos (bolsillos) de la proteína.
A diferencia de las proteínas NS3 (inhibidas por simeprevir, telaprevir y boceprevir) y NS5B (sofosbuvir), no se ha identificado ninguna función enzimática específica hasta el momento para la proteína NS5A, aunque es crucial en la producción de virus y se ha demostrado que está implicada en la modulación de la respuesta inmune del huésped y en la patogenicidad y la replicación del VHC. La proteína NS5A del VHC tiene 447 aminoácidos y su forma activa es como un homodímero que se organiza en tres ámbitos diferentes, de los cuales el dominio I es el más conservado y con una estructura más compleja. La NS5A puede existir en estado fosforilado o hiperfosforilado.
Daclatasvir tiene un mecanismo único, con un sitio de unión simétrico. Los anillos de bifenilo descansan en la parte superior de los dos grupos metilo del aminoácido Thr(T)95 en los dos monómeros de la NS5A. Los anillos de los dos residuos Tyr(Y)93 extienden el canal hidrófobo para acomodar el resto del grupo bifenilo y uno de los anillos laterales del daclatasvir. Las cadenas de Lys(K)26, Ile(I)27, y Ile(I)28 de las dos α-hélices y Pro(P)97 de cada monómero completan las esquinas hidrófobas, permitiendo que el fármaco se ajuste fácilmente en la ranura hidrófoba formada en la esquina de los bolsillos de la proteína NS5A. Los restos Arg(R)30 y Gln(Q)54 forman cuatro enlaces de hidrógeno simétricos con daclatasvir (Barakat, 2014).
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad del daclatasvir en la indicación autorizada han sido contrastadas mediante dos ensayos clínicos principales de fase III, tanto en pacientes naïve (no tratados previamente) como en aquellos pretratados. En todos los casos, la variable primaria de eficacia utilizada fue la tasa de pacientes con respuesta virológica sostenida, es decir, aquellos con niveles séricos de menos de 25 copias/ml de ARN del VHC, medidos 12 semanas después de haber finalizado el tratamiento completo antiviral (RVS12). La dosis empleadas fueron de 60 mg/24 h de daclatasvir, 400 mg/24 h de sofosbuvir, 500 o 600 mg/12 h (según peso) de ribabvirina, en todos los casos por vía oral, y de la peginterferón alfa-2a fue de 180 µg/semana, por vía subcutánea.
El estudio principal (AI444040; Sulkowski, 2014) es un ensayo clínico abierto y multicéntrico realizado sobre 211 pacientes en total, en el que se incluyeron pacientes con infección por VHC de genotipo 1a/1b no tratados previamente (naïve, 126 pacientes) o pretratados y con fallo virológico a boceprevir/telaprevir (41 pacientes), así como pacientes naïve con VHC de genotipo 2/3 (44 pacientes).
Los pacientes naïve con VHC de genotipo 1a/1b fueron aleatoriamente asignados a un tratamiento de 12 semanas con daclatasvir y sofosbuvir, con o sin ribavirina (DAC/SOF/RBV12, DAC/SOF12) o de 24 semanas (DAC/SOF/RBV24, DAC/SOF24); los pacientes pretratados con boceprevir/telaprevir y con fallo virológico y los pacientes naïve con VHC de genotipo 2/3 fueron tratados durante 24 semanas (DAC/SOF/RBV24, DAC/SOF24).
En los pacientes naïve con VHC de genotipo 1a/1b (122), la mediana de edad era de 54-56 años, un 51% eran varones y un 80% eran de raza blanca; la mediana de la carga viral era de 6,1-6,8 log10 (1,3-6,3 millones de copias de ARN por ml). Un 79% presentaban VHC de genotipo 1a y el 21% restante 1b. La tasa global de respuesta (RVS12) fue del 98,2% con DAC/SOF/RBV (con ribavirina) y del 100% con DAC/SOF (sin ribavirina). Las tasas fueron del 100% en ambos grupos de 24 semanas de duración (DAC/SOF/RBV24 y DAC/SOF24), del 100% con DAC/SOF12 y del 95,1% con DAC/SOF/RBV12.
En los pacientes con VHC de genotipo 1a/1b pretratados y con fallo virológico al boceprevir/telaprevir (41) la mediana de edad era de 57-59 años, un 61% eran varones y un 90% eran de raza blanca; la mediana de la carga viral era de 6,3-6,4 log10 (2,0-2,5 millones de copias de ARN por ml). Un 80% presentaban VHC de genotipo 1a y el 20% restante 1b. La tasa global de respuesta fue del 98% tanto con DAC/SOF/RBV24 (con ribavirina) como DAC/SOF24 (sin ribavirina).
Finalmente, en los pacientes con VHC de genotipo 2/3 naïve (44) la mediana de edad era de 50-52 años, un 50% eran varones y un 86% eran de raza blanca; la mediana de la carga viral era de 6,7-6,9 log10 (5,0-7,9 millones de copias de ARN por ml). Un 59% presentaban VHC de genotipo 2 y el 41% restante 3. La tasa global de respuesta fue del 93,2%, un 92,9% con DAC/SOF/RBV24 (con ribavirina) y un 93,3% con DAC/SOF24 (sin ribavirina). Considerando específicamente los genotipos virales, la tasa de respuesta viral sostenida fue del 96,2% para el genotipo 2 y del 88,9% para el 3.
El estudio AI444042 es un ensayo clínico abierto y multicéntrico realizado sobre 125 pacientes naïve con infección por VHC de genotipo 4, asignados aleatoriamente a recibir peginterferón alfa y ribavirina (IFN/RBV), junto con daclatasvir (60 mg/24 h) o placebo. En aquellos pacientes que mostraron niveles indetectables de ARN viral, se completó el tratamiento hasta la semana 24, mientras que los restantes siguieron recibiendo la combinación IFN/RBV hasta la semana 48. La mediana de edad de los pacientes era de 48 años, un 73% eran varones y un 77% eran de raza blanca; la mediana de la carga viral era de 5,7 log10 (0,5 millones de copias de ARN por ml). La la tasa de respuesta viral sostenida fue del 81,7% con daclatasvir vs. 42,9% con placebo.
Los datos de seguridad clínica del daclatasvir muestran un perfil toxicológico benigno, sin efectos adversos específicos, que motiva la suspensión del tratamiento solo en el 1-2% de los casos. En el ensayo clínico principal ninguno de los pacientes experimentó ningún evento adverso de grado 3/4 relacionado con el tratamiento, a pesar de recibir también sofosbuvir y, en algunos pacientes, ribavirina. Los eventos adversos más comunes fueron fatiga (31,7% para DAC/SOF/RBV12 vs. 30,6% para DAC/SOF/RBV24, y 31,7% para DAC/SOF12 vs. 25,0% para DAC/SOF24), cefalea (14,6% vs. 26,5% y 14,6% vs. 18,8%) y náusea (12,2% vs. 20,4% y 17,1% vs. 10,0%).
ASPECTOS INNOVADORES
El daclatasvir es un agente antiviral activo frente a virus de la hepatitis C (VHC), que actúa inhibiendo específicamente la proteína NS5A, una proteína con diversas funciones relacionadas con la replicación del VHC y el ensamblaje de los viriones. Ha sido autorizado para el tratamiento, en combinación con otros medicamentos, de la hepatitis C crónica en adultos.
La eficacia de la combinación con sofosbuvir ha sido claramente demostrada en pacientes con genotipo viral 1, 2, 3 y 4, con tasas de respuesta viral sostenida por encima del 90%. En el caso de los genotipos 1a y 1b también se ha demostrado esta misma elevada tasa de respuesta en pacientes que habían experimentado un fallo viral previo a boceprevir o telaprevir. Presenta un perfil de seguridad muy benigno, con efectos adversos inespecíficos (fatiga, cefalea, náusea) y poco intensos.
Se trata de un nuevo agente activo frente al VHC que presenta un mecanismo de acción diferente de los fármacos hasta ahora utilizados y su potencia antiviral es, sin duda, muy elevada, actuando – al menos in vitro – sobre todos los genotipos de VHC. No obstante, el daclatasvir tiene una baja barrera de resistencia a las mutaciones para algunos genotipos, particularmente para 1a, 2a, 2b y 3a. Aunque actualmente está siendo objeto de varios ensayos clínicos (16 en la Unión Europea; EMA, 2015), los datos clínicos disponibles hasta ahora para el daclatasvir no son equiparables en cantidad ni en diversidad a los de simeprevir y, especialmente, de sofosbuvir; en este sentido, es particularmente relevante la muy escasa experiencia clínica actual en pacientes con cirrosis o enfermedad hepática avanzada.
La última versión de la Guía de Práctica Clínica de la Asociación Europea para el Estudio del Hígado (EASL, 2014) establece como opciones preferentes de tratamiento de la hepatitis C crónica producida por VHC de genotipo 1a y 1b las combinaciones de sofosbuvir o de simeprevir con peginterferon alfa + ribavirina. Como alternativas recomienda daclatasvir junto con peginterferon + ribavirina, sofosbuvir + simeprevir durante 12 semanas o sofosbuvir + daclatasvir durante 12 o 24 semanas, según las condiciones de los pacientes. Para el genotipo 2 se recomienda una combinación de ribavirina y sofosbuvir durante 12 semanas (16-20 en casos de pacientes cirróticos). Para el genotipo 3, la combinación es de sofosbuvir con peginterferon alfa-2a y ribavirina durante 12 semanas, y como alternativas ribavirina y sofosbuvir durante 12 semanas (no aconsejable en pacientes cirróticos) o sofosbuvir y daclastavir durante 12 (naïve) o 24 semanas (pretratados). Para los cuadros asociados al genotipo 4, se aconseja el simeprevir durante 12 semanas asociados a peginterferón y ribavirina durante 24 o 48 semanas (naïve o pretratados), citándose como alternativas peginterferón más ribavirina y daclastavir durante 24 semanas o sofobuvir y ribavirina durante 24 semanas.
Tras la primera oleada de antivirales específicos frente al VHC, con boceprevir y telaprevir, que ciertamente modificaron en 2011 el pronóstico y las expectativas terapéuticas en este campo, el daclatasvir forma parte de una segunda oleada – junto con simeprevir y sofosbuvir, incorporados en 2014 – que completa el perfil de mecanismos farmacológicos relacionados con el bloqueo de la proteasa del VHC. Estos tres fármacos, con el sofosbuvir a la cabeza como referente, presentan elevadas tasas de curación en diversos subtipos de pacientes, a través de regímenes orales sencillos y bien tolerados, con la particularidad de que permiten eliminar en algunos casos la otrora imprescindible presencia del interferón alfa e incluso de la ribavirina en el tratamiento, origen de importantes y frecuentes efectos adversos, amén de acortar sustancialmente la duración del tratamiento y con ello facilitar la adherencia al mismo y su tolerabilidad.
A esta tríada de nuevos inhibidores de la proteasa del VHC habrá que añadir próximamente otros fármacos, como ledipasvir o asunaprevir, pero ya no aportarán nuevos mecanismos y es poco probable que se mejoren sustancialmente la tasa de respuesta viral (ya muy elevada); también es inminente la autorización de combinaciones (combos) de varios antivirales en formulaciones únicas, al estilo de las existentes para el tratamiento de la infección por VIH.
|
VALORACIÓN |
|
|---|---|
|
Daclatasvir ► DAKLINZA® (Bristol-Myers Squibb) |
|
|
Grupo Terapéutico (ATC): J05AE. ANTIINFECCIOSOS SISTÉMICOS. Antivirales de acción directa: inhibidores de la proteasa. |
|
|
Indicaciones autorizadas: Tratamiento, en combinación con otros medicamentos, de la hepatitis C crónica en adultos. |
|
|
VALORACIÓN GLOBAL: INNOVACIÓN IMPORTANTE. Aportación sustancial a la terapéutica estándar. |
♣ ♣ ♣ |
|
Novedad clínica: Alta tasa de eficacia, posibilidad de asociar con otros tratamientos actualmente en vigor y utilidad en cuadros refractarios a los tratamientos actuales o en pacientes en los que el tratamiento estándar está contraindicado. |
⇑ |
|
Novedad molecular: Mecanismo de acción innovador |
⇑ |
|
Novedad toxicológica: Mejora el perfil toxicológico con relación a la terapia farmacológica estándar. |
⇑ |
|
FÁRMACOS RELACIONADOS REGISTRADOS ANTERIORMENTE EN ESPAÑA |
|||
|---|---|---|---|
| Fármaco | Medicamento® | Laboratorio | Año |
|
Boceprevir |
Victrelis |
Merck Sharp Dohme |
2011 |
|
Telaprevir |
Incivo |
Janssen Cilag |
2011 |
|
Simeprevir |
Olysio |
Janssen Cilag |
2014 |
|
Sofosbuvir |
Sovaldi |
Gilead |
2014 |
|
Daclatasvir |
Daklinza |
Bristol-Myers Squibb |
2015 |
BIBLIOGRAFÍA
Bibliografía
- Barakat KH, Anwar-Mohamed A, Tuszynski JA, Robins MJ, Tyrrell DL, Houghton M. A refined model of the HCV NS5A protein bound to daclatasvir explains drug-resistant mutations and activity against divergent genotypes. J Chem Inf Model. 2014 Apr 14. dx.doi.org/10.1021/ci400631n
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S. Sofosbuvir (Sovaldi) en hepatitis C. Panorama Actual Med. 2014; 38 (377): 835-40.
- European Medicines Agency (EMA). Daklinza®. European Public Assessment Report (EPAR). EMA/401520/2014; EMEA/H/C/003768. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/003768/WC500172849.pdf
- European Medicines Agency (EMA). Clinical trials for daclatasvir. https://www.clinicaltrialsregister.eu/ctr-search/search?query=daclatasvir (23 de enero de 2015)
- European Association for the Study of the Liber (EASL). Recommendations on Treatment of Hepatitis C 2014. http://www.easl.eu/_newsroom/latest-news/easl-recommendations-on-treatment-of-hepatitis-c-2014
- Sulkowski MS, Gardiner DF, Rodriguez-Torres M, Reddy KR, Hassanein T, et al; AI444040 Study Group. Daclatasvir plus sofosbuvir for previously treated or untreated chronic HCV infection. N Engl J Med. 2014; 370(3): 211-21. doi: 10.1056/NEJMoa1306218.
1 EC50% es la concentración efectiva para inhibir el 50% de los virus.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares




