Cobimetinib (▼Cotellic®, Roche) en melanoma
 Nº398
Nº398
Resumen
El cobimetinib es un agente antineoplásico autorizado para el tratamiento en combinación con vemurafenib de pacientes adultos con melanoma no resecable o metastásico con mutación BRAF V600, que actúa inhibiendo potente y selectivamente determinadas proteína cinasas activadas por mitógenos (MAPK) implicadas especialmente en la proliferación celular tumoral, mediante un bloqueo de los procesos de fosforilización, al competir con ATP/GTP. Por su parte, el vemurafenib actúa inhibiendo potente y selectivamente las diversas formas mutadas de la serina-treonina cinasa BRAF. Tras un seguimiento medio de más de 14 meses, la supervivencia libre de progresión tumoral fue cinco meses mayor con la combinación cobimetinib/vemurafenib vs. vemurafenib/placebo, con una reducción de la tasa de riesgo de muerte o de progresión tumoral del 42%. Asimismo, la supervivencia global aumentó en 5 meses, con una reducción de la mortalidad del 30%. Desde el punto de vista de la seguridad, la combinación de cobimetinib/vemurafenib presenta un perfil toxicológico importante, equiparable al de otros agentes inhibidores de proteína cinasa, siendo la mayoría de los eventos descritos de grado 3 o superior.
ASPECTOS FISIOPATOLÓGICOS
Los melanomas son tumores cutáneos malignos se originan a partir de los melanocitos, aunque estos también pueden dar lugar crecimientos benignos (no cancerosos), como son los lunares. El melanoma es, con toda seguridad, la forma de cáncer cutáneo más peligrosa, por su facilidad para diseminarse por otros tejidos haciendo metástasis en diversos órganos distales (cerebro, hígado, pulmones, etc.), aunque si se detecta con la antelación necesaria puede ser eficazmente erradicado.
La prevalencia del melanoma tiene una gran variabilidad geográfica. Es uno de los 10 tumores malignos más frecuentes en el mundo occidental, pero es raro en la mayoría de los países de África, Asia y Sudamérica y, en general, la incidencia del melanoma en todo el mundo aumenta a medida que nos acercamos al Ecuador, pero no así en Europa, donde es más frecuente en países nórdicos. En las últimas décadas, su número se ha incrementado de manera importante y se trata de uno de los tumores malignos que más ha aumentado en la población blanca. Se estima que cada 10 o 20 años se duplica su número.
España tiene una de las tasas de incidencia y mortalidad del melanoma más bajas de los países desarrollados; aunque, sin embargo, es una de las patologías de mayor crecimiento en nuestro país, con un aumento del 181,3% en la tasa de incidencia en hombres y aumento 205,3 % en las mujeres. Representa el 1,3% y el 2,5% de los tumores malignos en hombres y mujeres, respectivamente, mientras que la tasa estandarizada en todo el mundo actual es, respectivamente, 2,4% y 4,9%. En concreto, en España la incidencia ajustada por 100.000 habitantes es de 5,2 para el total de población, siendo más común en las mujeres (57,2%), con una edad media en el momento del diagnóstico de 55 años en las mujeres y 57 años en los hombres; el subtipo histológico más frecuente el de extensión superficial (60%). A pesar del aumento del número de casos, la mortalidad permanece estable, probablemente en relación con la mejoría diagnóstica y precocidad quirúrgica. Esta mayor incidencia en el sexo femenino diferencia a España del resto de Europa y Estados Unidos, en donde ocurre lo contrario.
Como se ha indicado, los melanomas derivan de los melanocitos, fundamentalmente de aquellos localizados en la unión dermoepidérmica; en general, es más común en partes descubiertas de la piel y en personas inmunosuprimidas. Aunque más del 95% de los casos de melanoma tienen localización cutánea, no se considera un cáncer exclusivamente cutáneo ya que puede aparecer en ojo, mucosas, tracto gastrointestinal, tracto urogenital, meninges y nódulos linfáticos. En cualquier caso, el melanoma es el tumor maligno cutáneo más importante en razón de su pronóstico, ya que es el responsable de la mayoría de las muertes asociadas a cánceres cutáneos. La mayoría se origina de novo y otras veces aparece sobre nevos melanocíticos preexistentes.
El melanoma se presenta predominantemente en adultos y más de 50% de los casos aparecen en áreas de la piel que son aparentemente normales. Entre los primeros signos en el nevo que indican cambios malignos están una coloración más oscura o variable, picazón, un aumento en el tamaño o el surgimiento de formaciones satélites. La ulceración o hemorragia son signos tardíos. El melanoma en mujeres se presenta con mayor frecuencia en las extremidades, y en hombres generalmente se presenta en el tronco, o en la cabeza y cuello, pero puede surgir en cualquier sitio de la superficie cutánea. La lesión típica es una mancha, generalmente asimétrica, mayor de 6 mm de diámetro, cuya coloración varía desde el marrón claro hasta el negro intenso, y generalmente irregular, con bordes dentados. Estas 4 características clínicas constituyen la denominada regla ABCD del melanoma (A: asimetría; B: bordes irregulares; C: color intenso; y D: diámetro mayor de 6 mm). Sin embargo, estos criterios también pueden observarse en lesiones melanocíticas benignas, así como hay melanomas que no las cumplen, por lo que no constituyen criterios diagnósticos absolutos. Clínicamente, se distinguen cuatro tipos de melanoma:
- Melanoma lentigo maligno. Se origina en la piel fotoexpuesta de la cara de personas de edad avanzada, con fototipo bajo y daño solar crónico. Consiste en una mancha irregular con zonas más claras, con bordes irregulares. La lesión tiene un crecimiento lento y progresivo y, al cabo de un tiempo variable, generalmente años, aparece una elevación dentro de la mancha indicando que la lesión ya ha invadido la dermis.
- Melanoma de extensión superficial. Es el más frecuente. Las localizaciones preferentes son el tronco en hombres y las piernas en mujeres. Es una placa de coloración oscura, con las características ya señaladas, a veces negruzca, generalmente intensa, sobre la que ulteriormente aparece una lesión elevada.
- Melanoma acrolentiginoso y mucoso. Es más frecuente en las personas de raza negra, apareciendo en palmas, plantas, región subungueal y en mucosas. Es una mácula amplia, de coloración desigual y bordes irregulares, en cuya superficie se pueden encontrar lesiones papulosas o tuberosas.
- Melanoma nodular. Aparece como una lesión papulosa o papulotuberosa, de tamaño variable y de superficie habitualmente negruzca, aunque puede ser incolora (melanoma amelanótico), que puede estar erosionada o ulcerada. Es la forma clínica de más rápido crecimiento y de peor pronóstico.
En la génesis del melanoma intervienen factores genéticos y adquiridos. De entre estos, la exposición a la luz ultravioleta parece el de mayor importancia, singularmente si es esporádica e intensa, aunque no todos los melanomas están relacionados con el sol. Aparecen más frecuentemente en fototipos I y II (se ponen morenos con dificultad pero se queman fácilmente y se suele acompañar de ojos y pelo claros). La existencia de antecedentes personales o familiares de melanoma o de quemaduras solares en la niñez, un número elevado de nevos, y la presencia de nevos congénitos grandes son considerados factores de riesgo.
En cualquier caso, la genética tiene una relevancia especial en el melanoma, ya que las mutaciones típicamente asociadas al melanoma están presentes en el 10-40% de las familias con una tasa elevada de melanoma. En este sentido, más del 65% de los melanomas contienen mutaciones activadoras de la vía RAS/RAF/MEK/ERK, entre las que las mutaciones en la cinasa BRAF se llegan a identificar en el 40-50% de los melanomas cutáneos, en particular en la posición V600 (sustitución de valina por otro aminoácido en dicha posición de la cadena proteica de la cinasa); entre el 74% y el 90% de las mutaciones V600 detectadas en clínica son V600E (valina por ácido glutámico), seguidas en frecuencia por la V600K (15-25%); muchos menos comunes son las V600R, D, G, M, A y WT. Otro 10-15% tienen la mutación NRAS.
Por otro lado, los propios antecedentes personales son un factor de riesgo asociado al melanoma, ya que una persona que ha lo padecido anteriormente tiene un mayor riesgo de padecer otro melanoma. Se estima que el 5% de las personas con melanoma padecerán un segundo melanoma en algún momento de sus vidas. Para pacientes con melanoma metastásico o irresecable quirúrgicamente, el pronóstico es poco favorable, con una tasa de supervivencia al cabo de un año desde el diagnóstico del 25%, que desciende al 15% a los cinco años.
El objetivo general del tratamiento del melanoma no metastásico es la curación del proceso. Para ello, el tratamiento debe ser precoz y definitivo, individualizado de acuerdo con el tipo de tumor, el tipo de paciente y la experiencia clínica. En principio, los melanomas cutáneos in situ pueden ser tratados con cirugía o con los diversos tratamientos médicos locales. La regresión espontánea ha sido reportada con una incidencia menor del 1% y aproximadamente el 20% de los pacientes diagnosticados de melanoma desarrollan metástasis, los cuales tienen una mediana de supervivencia de siete meses.
La terapia sistémica, como norma general, solo se recomienda cuando los pacientes no son tributarios de cirugía y los tumores son suficientemente invasivos o están diseminados. La dacarbazina se utiliza para el tratamiento del melanoma metastásico y durante mucho tiempo se consideró como el fármaco de mayor eficacia como agente único. Las tasas de respuesta están en torno al 20% (del que un 5% son remisiones completas), con una mediana de duración de las respuestas de 4-6 meses. Los principales efectos secundarios son náuseas y vómitos. Por su parte, la temozolomida es semejante a la dacarbazina, pero es capaz de atravesar la barrera hematoencefálica y puede ser absorbida por vía oral; por ello, se utiliza preferentemente como tratamiento de las metástatis cerebrales del melanoma. Se pueden utilizar asimismo tratamientos combinados diversos, asociando dacarbazina junto con otros agentes citotóxicos, como cisplatino, vinblastina, carmustina o tamoxifeno.
La terapia adyuvante con interferón alfa es un tratamiento adicional para los pacientes con alto riesgo de recaída después del tratamiento quirúrgico del melanoma (primarios de grosor >4 mm o con enfermedad nodal), habiendo demostrado aumento de la supervivencia libre de enfermedad. Hay que tener en cuenta que el promedio de supervivencia del melanoma en estadio avanzado rondaba los 8 meses hasta hace poco tiempo y que ninguna terapia sistémica había demostrado de manera significativa aumentar la supervivencia. La opción de la observación y el tratamiento conservador es razonable, sobre todo en los pacientes asintomáticos, ancianos o con comorbilidades graves.
Entre los inhibidores de tirosina cinasas o, más genéricamente, de proteína cinasas, cabe destacar al vemurafenib, al dabrafenib y al trametinib. Este último actúa inhibiendo selectivamente las MEK1 y MEK2 (Mitogen-activated Extracellular signal regulated Kinase 1 y 2), componentes de la vía de señalización extracelular relacionadas con cinasas (ERK), al impedir la activación de las MEK por diversas formas mutadas de la serina-treonina cinasa BRAF, a su vez relacionadas con la promoción de la proliferación celular en ausencia de factores de crecimiento.
Más del 65% de los melanomas contienen mutaciones activadoras de la vía extracelular RAS/RAF/MEK/ERK, entre las que las mutaciones en la cinasa BRAF se llegan a identificar en el 40-50% de los melanomas cutáneos, en particular en la posición V600 (sustitución de valina por otro aminoácido en dicha posición de la cadena proteica de la cinasa); entre el 74% y el 90% de las mutaciones V600 detectadas en clínica son V600E (valina por ácido glutámico), seguidas en frecuencia por la V600K (15-25%); muchos menos comunes son las V600R, D, G, M, A y WT.
Por su parte, el ipilimumab es un anticuerpo monoclonal que impide la acción del Antígeno 4 de los Linfocitos T Citotóxicos (CTLA-4), el cual es un regulador negativo de la activación de los linfocitos, por lo que el efecto del ipilimumab se traduce en la activación y proliferación de linfocitos T, así como de su infiltración tumoral, lo que provoca la destrucción de las células tumorales. Ha sido autorizado para el tratamiento del melanoma avanzado (irresecable o metastásico) en adultos que han recibido tratamiento anterior. El desarrollo de este medicamento se basó en el hecho de que el melanoma es uno de los cánceres con mayor actividad inmunogénica, por lo que el ipilimumab está enfocado a potenciar las respuestas inmunológicas antitumorales naturales. En concreto, el ipilimumab interfiere en el proceso de interacción entre el CTLA-4 y las moléculas B7 (CD80/CD86) portadas por las células presentadoras de antígenos. Esto conduce a una potenciación de los linfocitos T debido al bloqueo de la modulación inhibitoria promovida por la interacción CTLA-4/B7. Sin embargo, no se han observado modificaciones en las frecuencias de linfocitos T CD4+ o CD8+, ni en la expresión de otros marcadores de subpoblaciones linfocitarias (CD89, CD25, HLS-DR, etc.). En definitiva, el empleo de ipilimumab no parece provocar una sobreestimulación generalizada del comportamiento de los linfocitos T.
Finalmente, el nivolumab es un anticuerpo monoclonal que se une al receptor de muerte programada PD-1 (programmed death 1) presentes en la superficie de los linfocitos T, impidiendo la interacción de este con sus ligandos (PD-L1 y PD-L2). El receptor PD-1 es un regulador negativo de la actividad de los linfocitos T, particularmente en los efectos relacionados con el control de la respuesta inmune de estas células. La unión del receptor PD-1 con dichos ligandos, que están expresados en diversos tipos de células tumorales (así como en las células presentadoras de antígenos, APC), provoca la inhibición de la proliferación de los linfocitos T y de su secreción de citocinas; en consecuencia, el nivolumab potencia la respuesta antitumoral de los linfocitos T. Es preciso tener en cuenta que el balance de la inmunidad mediada por las células T es determinante en el control de enfermedades infecciosas y del cáncer, así como en el desarrollo de tolerancia inmunológica a los antígenos propios (a través de las células presentadoras de antígenos, APC). La inducción y mantenimiento de la tolerancia mediada por células T a través de la vía PD-1/PD-L limita la respuesta de subpoblaciones de células T efectoras para evitar daño tisular como resultado de una mayor actividad de la inmunidad. Las alteraciones en la interacción de PD-1 y sus ligandos PD-L1 y PD-L2 son utilizadas como un mecanismo de escape inmunológico por las células tumorales facilitando la progresión del cáncer; asimismo ciertos microorganismos pueden alterar esta vía dando como resultado el desarrollo y progresión de las infecciones crónicas (Cuéllar, 2016).
ACCIÓN Y MECANISMO
El cobimetinib es un agente antineoplásico que actúa inhibiendo potente y selectivamente determinadas proteína cinasas activadas por mitógenos (MAPK) implicadas especialmente en la proliferación celular tumoral, mediante un bloqueo de los procesos de fosforilación, al competir con ATP/GTP. En concreto, inhibe selectivamente MEK1 y MEK2 (mitogen-activated extracellular signal regulated kinase 1 y 2)1, componentes de la vía de señalización extracelular relacionadas con cinasas (ERK), al impedir la activación de las MEK por diversas formas mutadas de la serina/treonina cinasa BRAF, a su vez relacionadas con la promoción de la proliferación celular en ausencia de factores de crecimiento, lo que se traduce en una inducción de la apoptosis de las células afectadas. Carece prácticamente de actividad sobre otras tirosina y serina/treonina cinasas implicadas en los procesos de señalización celular.
Más del 65% de los melanomas contienen mutaciones activadoras de la vía extracelular RAS/RAF/MEK/ERK, entre las que las mutaciones en la cinasa BRAF se llegan a identificar en el 40-50% de los melanomas cutáneos, en particular en la posición V600 (sustitución de valina por otro aminoácido en dicha posición de la cadena proteica de la cinasa); entre el 74% y el 90% de las mutaciones V600 detectadas en clínica son V600E (valina por ácido glutámico), seguidas en frecuencia por la V600K (15-25%); muchos menos comunes son las V600R, D, G, M, A y WT.
El vemurafenib actúa inhibiendo potente y selectivamente las diversas formas mutadas de la serina-treonina cinasa BRAF. De ahí que la acción conjunta del cobimetinib con el vemurafenib provoque un grado mayor de inhibición de la señalización intracelular y una reducción de la proliferación de las células tumorales con mutación BRAF. Atendiendo a ello, el medicamento ha sido autorizado para el tratamiento en combinación con vemurafenib de pacientes adultos con melanoma no resecable o metastásico con mutación BRAF V600.
ASPECTOS MOLECULARES
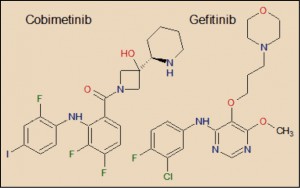
El cobimetinib está estrechamente relacionado farmacológicamente con otros miembros de la serie de inhibidores de proteína cinasas. Aunque se aprecia una cierta diversidad estructural entre todos ellos, es evidente el paralelismo estructural entre cobimetinib con el gefitinib. En cualquier caso, todos ellos guardan – en mayor o menor grado – una familiaridad química con las moléculas de ATP y GTP, con las cuales compiten para provocar el bloqueo de la cinasa correspondiente.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas del cobimetinib han sido adecuadamente contrastadas en las indicación autorizada mediante un ensayo clínico de fase 3 (confirmatorio de eficacia y seguridad), aleatorizado, multicéntrico, doblemente ciego y controlado con placebo, realizado en un conjunto de 495 pacientes adultos con melanoma irresecable en fase IIIC (avanzado) o IV (metastásico), con mutación BRAF(V600)-positivos y no tratados con anterioridad con inhibidores de BRAF (Larkin, 2014).
Los pacientes fueron aleatoriamente asignados a recibir por vía oral cobimetinib (60 mg/24 h durante 21 días, seguidos de 7 días de descanso, en ciclos de 28 días) o placebo, en combinación con vemurafenib (960 mg/12 h). Las características fisiopatológicas de los pacientes eran: 55 años de mediana de edad (27% con 65 o más años), 58% varones, 40% en fase IIIC/M1A/M1B y 60% (M1C) y con una mediana de tiempo desde el primer diagnóstico de melanoma de 26 meses. La variable primaria de eficacia fue la supervivencia libre de progresión tumoral, mientras que la secundaria fue la supervivencia global.
En un análisis intermedio, la mediana de supervivencia libre de progresión tumoral fue de 9,9 meses para la combinación cobimetinib/vemurafenib vs. 6,2 meses para el grupo de control (vemurafenib/placebo), con una reducción de la tasa de riesgo de muerte o de progresión tumoral del 49% (HR=0,51; IC95% 0,39 a 0,68; p<0,001). Por su parte, la tasa de respuesta completa o parcial fue del 68% con la combinación vs. 45% en el grupo de control (p<0,001), incluyendo una tasa de respuesta completa del 10% para la combinación y del 4% para el grupo de control.
Tras un seguimiento medio de 14,2 meses (8,5-17,3), la mediana de supervivencia libre de progresión tumoral fue de 12,3 meses para la combinación cobimetinib/vemurafenib vs. 7,2 meses para el grupo de control (vemurafenib/placebo), con una reducción de la tasa de riesgo de muerte o de progresión tumoral del 42% (HR=0,58; IC95% 0,46 a 0,72; p<0,001). El análisis final de la supervivencia global se llevó a cabo cuando 255 pacientes (52%) de los incluidos en el estudio había muerto (Ascierto, 2016), encontrándose una mediana de 22,3 meses (IC95% 20,3 a no estimable) con la combinación vs. 17,4 meses (IC95% 15,0 a 19,8) para el grupo de control, lo que implica una reducción de la mortalidad en el periodo de 30% (HR=0,70; IC95% 0,55 a 0,90; p=0,005).
Desde el punto de vista de la seguridad, la combinación de cobimetinib/vemurafenib presenta un perfil toxicológico importante, equiparable al de otros agentes inhibidores de proteína cinasa, siendo la mayoría de los eventos descritos de grado 3 o superior. En general, la incidencia de eventos adversos fue superior con la combinación de cobimetinib/vemurafenib que con vemurafenib solo, siendo los eventos adversos más comunes que aparecieron durante el tratamiento: diarrea (57 vs. 28%), erupciones cutáneas, náuseas (39 vs. 24%), vómitos (21 vs. 12%), pirexia, fotosensibilidad (28 vs. 16%), incremento de los valores enzimáticos hepáticos (transaminasas: 22 vs. 13%) y musculares (creatina fosfocinasa: 30 vs. 2,9%). Por su parte, los eventos adversos de grado 3-4 que fueron más frecuentes con la combinación que en el grupo de control fueron el incremento de los valores de GGT (gammaglutamil transpeptidasa; 15 vs. 10%), el de los de creatina fosfocinasa (12 vs. 1%) y el de alanina transaminasa (11 vs. 6%). Se registraron eventos adversos graves en el 37% de los pacientes tratados con la combinación vs. 28% en el grupo de control, siendo los más comunes la pirexia y la deshidratación, ambos en un 2% de los pacientes (Ascierto, 2016).
En general, la mayor incidencia de eventos adversos se produce durante los primeros tres ciclos de tratamiento, lo que se manifiesta por la alta tasa de descontinuaciones (en torno al 20% con la combinación) y de reducciones/descontinuaciones temporales del tratamiento (al menos un 60% de los pacientes interrumpieron o redujeron la dosis de alguno de los medicamento en algún momento del estudio), lo que se relaciona con la mayor incidencia de eventos adversos al principio del tratamiento (EMA; 2015), dado que la reducción de la dosis de cobimetinib y/o de vemurafenib podría haber contribuido a la menor incidencia de eventos adversos durante los ciclos posteriores del tratamiento.
ASPECTOS INNOVADORES
El cobimetinib es un agente antineoplásico que actúa inhibiendo potente y selectivamente determinadas proteína cinasas activadas por mitógenos (MAPK) implicadas especialmente en la proliferación celular tumoral, mediante un bloqueo de los procesos de fosforilación, al competir con ATP/GTP. En concreto, inhibe selectivamente MEK1 y MEK2 (mitogen-activated extracellular signal regulated kinase 1 y 2)2, componentes de la vía de señalización extracelular relacionadas con cinasas (ERK), al impedir la activación de las MEK por diversas formas mutadas de la serina-treonina cinasa BRAF, a su vez relacionadas con la promoción de la proliferación celular en ausencia de factores de crecimiento, lo que se traduce en una inducción de la apoptosis de las células afectadas. Carece prácticamente de actividad sobre otras tirosina y serina/treonina cinasas implicadas en los procesos de señalización celular.
Por su parte, el vemurafenib actúa inhibiendo potente y selectivamente las diversas formas mutadas de la serina/treonina cinasa BRAF. De ahí que la acción conjunta del cobimetinib con el vemurafenib provoque un grado mayor de inhibición de la señalización intracelular y una reducción de la proliferación de las células tumorales con mutación BRAF. Atendiendo a ello, el medicamento ha sido autorizado para el tratamiento en combinación con vemurafenib de pacientes adultos con melanoma no resecable o metastásico con mutación BRAF V600.
El ensayo clínico pivotal muestra que tras un seguimiento medio de más de 14 meses, la supervivencia libre de progresión tumoral fue cinco meses mayor (12,3 vs. 7,2) con la combinación cobimetinib/vemurafenib vs. vemurafenib/placebo, con una reducción de la tasa de riesgo de muerte o de progresión tumoral del 42%. Asimismo, la supervivencia global aumentó en 5 meses (22,3 vs. 17,4), con una reducción de la mortalidad del 30%.
La combinación de cobimetinib/vemurafenib presenta un perfil toxicológico importante, equiparable al de otros agentes inhibidores de proteína cinasa, siendo la mayoría de los eventos descritos de grado 3 o superior. En general, la incidencia de eventos adversos es superior con la combinación de cobimetinib/vemurafenib que con vemurafenib solo, siendo los eventos adversos más comunes diarrea, náuseas, vómitos, pirexia, fotosensibilidad, incremento de los valores enzimáticos hepáticos y musculares.
No se dispone de estudios directamente comparativos de la cobimetinib/vemurafenib con otros agentes similares, como dabrafenib y trametinib. Sin embargo, la combinación de trametinib con dabrafenib ha demostrado (Robert, 2015; Long, 2015) su superioridad clínica frente a dabrafenib solo o a vemurafenib.
En los últimos años se han ido consolidando las dos principales líneas terapéuticas para los casos avanzados y metastásicos del melanoma. Por un lado, los anticuerpos monoclonales ipilimumab, pembrolizumab y nivolumab, que bloquean receptores clave de los linfocitos T; por otro, los inhibidores de la cinasa mutada BRAF vemurafenib y dabrafenib, asociados con trametinib o cobimetinib. De hecho, estas nuevas terapias han demostrado una mejora a largo plazo en la evolución del paciente, un beneficio que no ofrece la quimioterapia convencional. A pesar de ello, el tratamiento del melanoma sigue siendo un reto importante, habida cuenta del rápido desarrollo de resistencia tumoral a las líneas farmacológicas actuales, ante lo que las combinaciones inhibidores de MEK y de BRAF están ofreciendo una respuesta mejorada (Medina, 2016). En última instancia, la elección entre los tratamientos con inhibidores BRAF/MEK y la inmunoterapia (ipilimumab, etc.) debe ser individualizarse para cada paciente, teniendo en cuenta criterios clínicos y en particular la agresividad de la enfermedad.
|
VALORACIÓN |
|
COBIMETINIB
|
|
Grupo Terapéutico (ATC): L01XE. AGENTES ANTINEOPLÁSICOS E INMUNOMODULADORES. Otros: inhibidores directos de la proteína cinasa. |
|
Indicaciones autorizadas: Tratamiento en combinación con vemurafenib de pacientes adultos con melanoma no resecable o metastásico con mutación BRAF V600. |
|
INNOVACIÓN moderada. Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar |
|
FÁRMACOS RELACIONADOS REGISTRADOS EN ESPAÑA |
|||
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Imatinib |
Glivec |
Novartis |
2002 |
|
Erlotinib |
Tarceva |
Roche |
2006 |
|
Sunitinib |
Sutent |
Pfizer |
2007 |
|
Dasatinib |
Sprycel |
Bristol Myers Squibb |
2007 |
|
Sorafenib |
Nexavar |
Bayer |
2007 |
|
Lapatinib |
Tyverb |
Glaxo |
2008 |
|
Nilotinib |
Tasigna |
Novartis |
2008 |
|
Gefitinib |
Iressa |
AstraZeneca |
2010 |
|
Pazopanib |
Votrient |
Glaxo |
2011 |
|
Crizotinib |
Xalkori |
Pfizer |
2014 |
|
Vemurafenib |
Zelboraf |
Roche |
2014 |
|
Dabrafenib |
Tafinlar |
GlaxoSmithKline |
2014 |
|
Axitinib |
Inlyta |
Pfizer |
2014 |
|
Afatinib |
Giotrif |
Boehringer Ingelheim |
2014 |
|
Ruxolitinib |
Jakavi |
Novartis |
2015 |
|
Vandetanib |
Caprelsa |
AstraZeneca |
2015 |
|
Regorafenib |
Stivarga |
Bayer |
2015 |
|
Nintedanib |
Ofev |
Boehringer Ingelheim |
2015 |
|
Ibrutinib |
Imbruvica |
Janssen Cilag |
2016 |
|
Trametinib |
Mekinist |
Novartis |
2016 |
|
Cobimetinib |
Cotellic |
Roche |
2016 |
BIBLIOGRAFÍA
Bibliografía
- Ascierto PA, McArthur GA, Dréno B, Atkinson V, Liszkay G, Di Giacomo AM, et al. Cobimetinib combined with vemurafenib in advanced BRAF(V600)-mutant melanoma (coBRIM): updated efficacy results from a randomised, double-blind, phase 3 trial. Lancet Oncol. 2016; 17(9): 1248-60. doi: 10.1016/S1470-2045(16)30122-X.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S. Trametinib (Mekinist®; Novartis) en melanoma no resecable o metastásico. Panorama Actual Med 2016; 40(393): 450-6.
- European Medicines Agency (EMA). Cotellic®. European Public Assessment Report (EPAR). EMA/635489/2015; EMEA/H/C/003960. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/003960/WC500198565.pdf
- Larkin J, Ascierto PA, Dréno B, Atkinson V, Liszkay G, Maio M, et al. Combined vemurafenib and cobimetinib in BRAF-mutated melanoma. N Engl J Med. 2014; 371(20): 1867-76. doi: 10.1056/NEJMoa1408868.
- Long GV, Stroyakovskiy D, Gogas H, Levchenko E, de Braud F, Larkin J, et al. Dabrafenib and trametinib versus dabrafenib and placebo for Val600 BRAF-mutant melanoma: a multicentre, double-blind, phase 3 randomised controlled trial. Lancet. 2015; 386(9992): 444-51. doi: 10.1016/S0140-6736(15)60898-4.
- Medina TM, Lewis KD. The evolution of combined molecular targeted therapies to advance the therapeutic efficacy in melanoma: a highlight of vemurafenib and cobimetinib. Onco Targets Ther. 2016; 9: 3739-52. doi: 10.2147/OTT. S86774.
- Robert C, Karaszewska B, Schachter J, Rutkowski P, Mackiewicz A, Stroiakovski D, et al. Improved overall survival in melanoma with combined dabrafenib and trametinib. N Engl J Med. 2015; 372(1): 30-9. doi: 10.1056/NEJMoa1412690.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares





