Bosutinib ▼ Bosulif® (Pfizer) en leucemia mieloide crónica
 Nº402
Nº402
Resumen
Bosutinib es un agente antitumoral que forma parte del grupo de los inhibidores de la tirosina cinasa, actuando específicamente los receptores de tipo tirosina cinasa (RTK), como los de la proteína oncogénica BCR/ABL. Ha sido autorizado para su uso en el tratamiento de pacientes adultos con leucemia mieloide crónica con cromoso Philadelphia positivo, en fase crónica, fase acelerada o fase blástica, tratados previamente con uno o más inhibidores de la tirosina cinasa y para quienes imatinib, nilotinib y dasatinib no se consideran opciones adecuadas de tratamiento. Su eficacia ha sido contrastada en un ensayo clínico abierto y de brazo único (sin comparadores) en un amplio grupo de pacientes con leucemia mieloide crónica, mayoritariamente en fase crónica, pero también con un número relevante de pacientes en fase avanzada y plástica. Pero lo más importante es que se trataba en todos los casos de pacientes intolerantes al imatinib o que refractarios al tratamiento con éste, e incluso también se incluyó a pacientes que, además del imatinib, presentaban cuadros resistentes al dasatinib y/o al nilotinib. Por tanto, grupos de pacientes de segunda (resistencia al imatinib), de tercera (imatinib más nilotinib o dasatinib) o cuarta línea de tratamiento (imatinib más dasatinib más nilotonib); en definitiva, pacientes con un margen de actuación terapéutica muy restringido. Un paso más en la mejorar de la supervivencia de los pacientes con leucemia mieloide crónica refractaria a tratamientos previos.
ASPECTOS FISIOPATOLÓGICOS
La médula ósea produce inicialmente células madre sanguíneas indiferenciadas o pluripotenciales que, posteriormente, se transforman en células sanguíneas maduras, tanto de tipo mieloide como linfoide. Mientras que las células linfoides inmaduras acaban produciendo diferentes estirpes de linfocitos, las mieloides se pueden transformar en eritrocitos, ciertos leucocitos y megacariocitos (precursores de las plaquetas).
La leucemia mieloide (también denominada mielocítica o granulocítica) crónica, generalmente abreviada como LMC, es un trastorno mieloproliferativo clonal causado por la transformación maligna de una célula madre pluripotencial. Su principal característica es una producción anormalmente elevada de granulocitos, generalmente en la médula ósea, aunque no son raras las localizaciones extramedulares, como el bazo o el hígado. A pesar del predominio de la sobreproducción de granulocitos, el clon neoplásico también incorpora eritrocitos, megacariocitos, monocitos y linfocitos B y T. En la mayoría de los pacientes, el clon de la LMC progresa hacia una fase acelerada y una crisis blástica final, en la que pueden aparecer tumores mieloblásticos en otras localizaciones extramedulares, como huesos, sistema nervioso central, ganglios linfáticos y piel.
La leucemia mieloide crónica comprende el 15% de las leucemias del adulto. La mediana de la edad de presentación es de 67 años. Puede aparecer en ambos sexos, aunque es ligeramente más frecuente en los hombres que en las mujeres (1,4:1) y es infrecuente antes de los 10 años de edad: apenas un 2-3% de las leucemias infantiles son LMC. La mortalidad específica por edad aumenta de menos de 0,1 por 100.000 habitantes entre 0 a 14 años, a más de 8 por 100.000 en personas mayores de 80 años
La LMC es una enfermedad que se origina en la célula madre hematopoyética y se caracteriza por la traslocación recíproca entre los cromosomas 9 y 22, resultando en la formación del cromosoma Filadelfia. Esta traslocación resulta en una fusión cabeza-cola del punto de ruptura del gen BCR del cromosoma 22 en la banda q11 y el gen murino de leucemia Abelson (ABL) localizado en el cromosoma 9 en la banda q34. El producto de la fusión es el gen BCR-ABL que, al parecer, juega un papel central en el desarrollo de la LMC. La enfermedad ocurre en 3 fases: crónica, acelerada y blástica, aunque la mayoría de los pacientes son diagnosticados en la fase crónica:
- Fase crónica (FC): Alrededor del 85% de los pacientes suelen acudir en la fase proliferativa crónica de la LMC, mientras que el 15% restante se diagnostican con enfermedad avanzada. Los síntomas más frecuentes en el momento de la presentación en la FC son cansancio, pérdida de peso, sensación de plenitud abdominal y sudoración nocturna. En la mitad de los casos, la presentación clínica es asintomática; de hecho el 15 % de diagnósticos se realizan de modo casual, generalmente a partir un hemograma esporádico. Los síntomas y signos más frecuentes son muy inespecíficos, aunque mayoritariamente de tipo hipermetabólico (astenia, debilidad, anorexia, pérdida de peso, fiebre, sudación nocturna o sensación de plenitud abdominal), con aumento de los granulocitos o hemorragia. Su instauración suele ser paulatina y es frecuente una esplenomegalia, de carácter gigante en el 60-70% de los casos. La mediana de supervivencia en pacientes no tratados con leucemia mieloide crónica en fase crónica (LMC-FC) es de unos cinco años.
- Fase acelerada (FA): Su definición es vaga, ya que consiste en cualquier situación clínica no habitual en la fase crónica. En general, el cansancio, el dolor abdominal y la pérdida de peso se hacen cada vez más frecuentes e intensos, y surgen síntomas más graves como infección o sangrado frecuentes. A nivel celular, más células leucémicas desarrollan nuevas mutaciones. El 20 % de los pacientes fallece durante esta fase acelerada, siendo la mediana de supervivencia en esta fase es de 1-2 años.
- Fase blástica (FB): Es definida por la presencia de más de un 30% de formas blásticas o inmaduras en sangre periférica o médula ósea. Su inicio puede ser totalmente silente, con la aparición paulatina de síntomas inespecíficos como fiebre, pérdida de peso, sudación profusa, manifestaciones hemorrágicas, dolor óseo o esplénico. En ocasiones aparecen infiltrados leucémicos de partes blandas (sarcomas granulocíticos). En otros casos se encuentra infiltración ósea y en el 10 a 15 % de los casos progresa a un cuadro generalizado de mielofibrosis. La supervivencia a la fase blástica es inferior a 6 meses; de hecho, el 80% de las muertes en pacientes con LMC se produce por complicaciones en la fase blástica.
El pronóstico general de la LMC ha mejorado en las últimas décadas, pasando de una mediana de supervivencia de tres años y una tasa de supervivencia a los 5 años inferior al 20%, a ser de 5 años y del 50-60 %, respectivamente. Actualmente, la probabilidad de muerte durante el primer año tras el diagnóstico es de un 10 %, siendo en el segundo año del 12% y en cada año siguiente, del 22 %.
Se trata de una enfermedad adquirida, aunque por el momento no se han identificado factores predisponentes hacia ella. No obstante, en más del 95% de los casos existe una alteración citogenética denominada cromosoma Philadelphia (Ph1-positivo o Ph+), consistente en un cromosoma 22, al que le falta aproximadamente el 50% del material genético de su brazo largo, como consecuencia de una translocación recíproca con el cromosoma 9. Aproximadamente el 90 % de los pacientes presentan en el momento del diagnóstico el Ph+ en gran parte de las metafases medulares. En otro 5 % de los pacientes existen diferentes tipos de traslocaciones, simples o complejas, con el 22 y otros cromosomas. Y en el 5 % restante no se detecta el cromosoma Ph+ (son los casos conocidos como Ph- o Ph1-negativos), mostrando un cariotipo normal o con otros tipos de alteraciones citogenéticas que no afectan a los cromosomas 9 o 22.
La principal consecuencia de la alteración citogenética de la LMC es la formación del gen denominado BCR/ABL, resultado de la fusión de los genes BCR del cromosoma 22 y el ABL del cromosoma 9. El ABL (Abelson) es un protooncogén que está localizado en el brazo largo del cromosoma 9 de todas las células normales, y es responsable de codificación de una proteína de 140 kD (p140) que se expresa en todas las células y tiene una actividad tirosin fosfocinasa débil, cuya función fisiológica se desconoce todavía. Por su parte, el producto del gen BCR (Breakpoint Cluster Region) normal es una proteína tirosina cinasa anormal que desempeña un papel fundamental en la patogenia de la LMC y concretamente para el desarrollo de la alteración funcional de las células hemopoyéticas normales, al inhibir la apoptosis y, por lo tanto, facilitar la expansión del clon leucémico en la LMC.
El objetivo final del tratamiento en la leucemia mieloide crónica (LMC) es eliminar las células leucémicas que tiene la mutación BCR-ABL; aunque que como objetivo más inmediato se pretende reducir el recuento elevado de leucocitos, controlando los síntomas de los pacientes. La eficacia del tratamiento puede medirse en los niveles hematológico, citogenético y molecular.
Los parámetros hematológicos consisten en la variación conseguida en las cantidades relativas de leucocitos y específicamente el porcentaje de células sanguíneas inmaduras (blastos). Por su parte, el análisis citogenético indica el porcentaje de células Ph+ presentes, mientras que a nivel molecular, se determina el número de células que poseen la mutación BCR-ABL. En general, las tasas de respuesta en la LMC se establecen en función de obtener una adecuada respuesta hematológica en las fases avanzadas de la enfermedad (fases acelerada y blástica) y una respuesta citogenética en la fase crónica. En concreto, una respuesta hematológica implica presentar menos células mieloides inmaduras de la sangre periférica, lo que viene indicado por una reducción de los leucocitos a los valores normales. La respuesta hematológica puede es completa si no se detectan células inmaduras (menos de un 5% de blastos) y los recuentos son normales en sangre periférica, mientras que es parcial si se detecta la presencia de menos del 50% de células inmaduras y de plaquetas con relación a antes del tratamiento. Igualmente, una respuesta citogenética puede ser mayor (0-34% células Ph+): completa (0% células Ph+) o parcial (1-34%), y menor (35-65% células Ph+).
Por su parte, una respuesta molecular indica la presencia de menos células con la mutación BCR-ABL de la médula ósea o células de sangre periférica. Esta respuesta puede ser mayor (reducción de 3-log de los transcriptos de BCR-ABL de un valor basal estandarizado) o completa (sin transcriptos de BCR-ABL). En general, la respuesta molecular es la más difícil de alcanzar y, de hecho, por el momento no se ha alcanzado una respuesta molecular completa con las opciones terapéuticas actualmente disponibles en clínica.
En general, los niveles más elevados de respuesta se asocian a mejora del pronóstico. La consecución de una respuesta citogenética mayor es un indicador importante para predecir la supervivencia libre de progresión y la supervivencia en pacientes con leucemia mieloide crónica (LMC). Sin embargo, la mayoría de los pacientes en remisión citogenética completa siguen teniendo enfermedad residual, a través de mecanismos patogénicos todavía desconocidos. Por ello, cada vez cobra más importancia terapéutica la respuesta molecular como indicador pronóstico fiable y, de hecho, se estima que podría convertirse en el objetivo del tratamiento de la LMC en el futuro. También la rapidez en el tiempo de respuesta al tratamiento parece ser un factor de pronóstico favorable.
La hidroxicarbamida (hidroxiurea) y otros fármacos mielodepresores, como el busulfán, permiten conseguir que el paciente permanezca asintomático durante períodos prolongados de tiempo al mantener el recuento leucocitario total por debajo de 10.000/µl, pero no se alcanzan auténticas remisiones. La normalización de los leucocitos es paralela a la desaparición de todos los síntomas y signos de la enfermedad. Tanto el busulfán como la hidroxicarbamida pueden administrarse de forma oral y consiguen un buen control de la enfermedad y, aunque el busulfán logra controlar la enfermedad durante períodos de tiempo más prolongados, presenta mayor toxicidad que la hidroxiurea. Ambos agentes inducen remisiones hematológicas en el 70-80 % de los pacientes en fase crónica. Sin embargo, no previenen la progresión de la enfermedad ni prolongan de forma significativa la supervivencia. Sólo excepcionalmente se produce la desaparición transitoria de metafases con Ph+, siendo raras las respuestas citogenéticas.
El interferón alfa, administrado de forma aislada o en combinación con otros agentes, como la citarabina, induce una respuesta completa hematológica en el 70-80 % de los pacientes en fase crónica. La remisión hematológica va acompañada con la desaparición (respuesta completa) de las células Ph+ en la médula ósea en el 20-25% de los pacientes y reducción a menos del 35% (respuesta mayor) en otro 30-40% de los pacientes. En la mayoría de los casos donde la respuesta es completa, ésta se mantiene durante años. A pesar de este grado de respuesta, en el 90 % de los pacientes en respuesta citogenética completa se detecta el reordenamiento de bcr/abl, lo que implica una inadecuada respuesta molecular.
El imatinib fue el primer representante de los inhibidores de las tirosina cinasa utilizado en clínica. Las tirosina cinasas constituyen un conjunto de enzimas implicados en numerosas vías de señalización bioquímica, tanto en circunstancias fisiológicas como en procesos neoplásicos. Imatinib inhibe selectivamente a las tirosina cinasas codificadas por el gen ABL, incluyendo también las derivadas del BCR/ABL (presente en el cromosoma Filadelfia). La principal consecuencia de ello es la inhibición selectiva de la proliferación y la inducción de la apoptosis de las células Ph+, con lo cual se facilita la autodestrucción de las células neoplásicas. Imatinib es también un potente inhibidor del receptor tirosina cinasa para el factor de crecimiento derivado de las plaquetas (FCDP) y del factor de células troncales (FCT).
La eficacia del imatinib en pacientes en fase crónica de la leucemia mieloide crónica ha sido demostrada incluso durante periodos prolongados. Además, presenta una superioridad significativa en todos los indicadores estándar de la enfermedad frente a interferón solo o asociado a citarabina. A cinco años, la tasa estimada de recaída en pacientes es del 15-20%, mientras que el 5-10% progresa a la fase acelerada o a crisis blástica. No obstante, la tasa de supervivencia global estimada a los 5 años ronda el 90% y era superior que la registrada con cualquier otro tratamiento de leucemia mieloide crónica hasta el momento en que fue introducido en clínica (2002). Por todo ello, el imatinib se ha convertido en el tratamiento de referencia de la leucemia mieloide crónica.
Aunque la incorporación del imatinib ha mejorado la supervivencia en la forma crónica de la LMC, no ha habido mucha mejoría para los pacientes que se encuentran en una fase avanzada, ya que la supervivencia media con imatinib es de aproximadamente 18 meses en la fase acelerada y de 6,8 meses en la fase blástica. En definitiva, más de un 30% de los pacientes acaba abandonando el tratamiento, en parte también por motivos de toxicidad. La mayor parte de los casos de resistencia adquirida a imatinib son debidos a la recuperación de la actividad de la tirosina cinasa BCR/ABL, como consecuencia de mutaciones del dominio cinasa que impiden la unión eficaz del imatinib; también se asocia la aparición de resistencia con la amplificación genómica o adquisición de cromosomas Filadelfia adicionales. Por otro lado, el imatinib consigue la erradicación completa de la leucemia mieloide crónica solo en casos excepcionales. En la inmensa mayoría, persisten progenitores hematopoyéticos bcr/abl positivos que son resistentes. Este comportamiento celular implica una especie de reservorio de la enfermedad, a partir del cual se puede manifestar una sustancial resistencia. Precisamente, para luchar contra esta forma de resistencia se están desarrollando nuevos fármacos.
Por su parte, dasatinib (2007) presenta un mecanismo inhibidor de la tirosina cinasa BCR/ABL más selectivo y potente que el del imatinib, y más eficaz especialmente sobre los clones BCR/ABL resistentes a imatinib. En este sentido, dasatinib puede unirse tanto a la conformación activa como a la inactiva de la tirosina cinasa BCR-ABL incluso a bajas concentraciones, mientras que imatinib es incapaz de unirse a BCR-ABL en la forma activa. No obstante, todavía sigue sin obtenerse una cumplida respuesta frente a ciertos clones multirresistentes, como el T315I, frente al que dasatinib es también ineficaz. Dasatinib es eficaz para tratar todas las fases de la leucemia mieloide crónica (LMC) y la leucemia linfoblástica aguda (LLA) Ph+, obteniéndose respuestas hematológicas y citogenéticas tanto en pacientes resistentes como en intolerantes a imatinib en todas las fases (crónica, acelerada y blásticas) de la LMC.
En términos clínicos, el dasatinib es capaz de producir una respuesta hematológica sustancial (normalización del recuento de leucocitos y de plaquetas) por encima del 90% de los pacientes con leucemia mieloide crónica en fase crónica, tanto en pacientes resistentes (97%) como en intolerantes a imatinib (87%). Aunque menor que en la fase crónica, también se obtiene una respuesta hematológica completa en un porcentaje sustancial de pacientes con leucemia mieloide crónica en otras fases: acelerada (25-33%), blástica mieloide (17-35%) y blástica linfoide (26%) o con leucemia linfoblástica aguda Ph+ (33%). Por otro lado, es capaz de producir una respuesta citogenética amplia. Más de la mitad de los pacientes en fase crónica obtienen una respuesta citogenética mayor (<35% de células Ph+) que mayoritariamente es completa (0% de células Ph+). Sin embargo, la respuesta es nítidamente diferente según sean pacientes intolerantes a imatinib (respuesta mayor en el 73% y completa en el 56%) o resistentes a éste (31% y 22%).
El nilotinib (2008) es otro potente inhibidor de BCR-ABL, entre 10 y 30 veces más que el imatanib, y ha mostrado actividad in vitro frente a numerosos los mutantes de BCR-ABL resistentes a imatinib conocidos, pero no frente al T315I. Esta última mutación está presente en el 15-20% de los pacientes resistentes al tratamiento con imatinib. Nilotinib inhibe la actividad de BCR-ABL bloqueando el proceso de fosforilación. En términos clínicos, el nilotinib produce una respuesta citogenética mayor en el 49% de los pacientes en fase crónica, a lo largo de un año, mientras que en aquellos en fase acelerada se obtuvo una respuesta hematológica completa en el 42%, durante una media de 7 meses. Los efectos obtenidos son similares entre los pacientes que habían mostrado intolerancia o resistencia tumoral al imatinib. Hay datos que sugieren que una importante fracción de pacientes en fase acelerada con resistencia al nilotinib responde al tratamiento con dasatinib.
Con todo, el único tratamiento curativo de la leucemia mieloide crónica sigue siendo el trasplante de médula ósea a partir de un donante HLA-compatible durante la fase crónica de la enfermedad, pudiendo tener como resultado períodos libres de enfermedad prolongados y desaparición permanente del clon Ph+ (60% de los pacientes); cuando se realiza durante la fase acelerada o de crisis blástica es menos eficaz. Desgraciadamente, sólo un 10-15% de los pacientes son elegibles1 para esta técnica terapéutica, que además tiene asociado un impacto negativo sobre la calidad de vida y una elevada mortalidad (20-30%). Otros métodos terapéuticos consisten en radioterapia, focalizada sobre el bazo, que puede ser útil en los casos refractarios de LMC o en pacientes terminales con esplenomegalia gigante. No obstante, la respuesta generalmente es muy baja. La esplenectomía puede aliviar las molestias abdominales, mejorar la trombocitopenia y disminuir las necesidades transfusionales cuando la esplenomegalia no puede controlarse con quimioterapia o radioterapia.
ACCIÓN Y MECANISMO
Bosutinib es un agente antitumoral que forma parte del grupo de los inhibidores de la tirosina cinasa, actuando en concentraciones alcanzadas con las dosis terapéuticas sobre dichos enzimas, que están acoplados a multitud de receptores celulares y entre ellos, específicamente los receptores de tipo tirosina cinasa (RTK) los de la proteína oncogénica BCR/ABL. Ha sido autorizado para su uso en el tratamiento de pacientes adultos con leucemia mieloide crónica con cromosoma Philadelphia positivo, en fase crónica, fase acelerada o fase blástica, tratados previamente con uno o más inhibidores de la tirosina cinasa y para quienes imatinib, nilotinib y dasatinib no se consideran opciones adecuadas de tratamiento.
Tal eficacia se fundamenta en que la principal consecuencia de la alteración citogenética de la leucemia mieloide crónica es la formación del gen BCR/ABL, resultado de la fusión de los genes BCR del cromosoma 22 y el ABL del cromosoma 9, dando lugar al cromosoma PHiladelphia (Ph+). La expresión del gen BCR/ABL es una proteína tirosín cinasa anormal que desempeña un papel fundamental en el desarrollo de la alteración funcional de las células hematopoyéticas normales, al inhibir la apoptosis y, por lo tanto, facilitar la expansión del clon leucémico.
El bosutinib compite con el ATP por el lugar de unión del ATP en la tirosina cinasa codificada por el BCR-ABL (y otras proteína cinasas) impidiendo la activación o la sobreexpresión de diversas vías bioquímicas esenciales para las células malignas, a través del bloqueo del proceso de fosforilación. Es un inhibidor potente de las cinasas Src y Abl quinasa. El tratamiento con Bosutinib inhibe la actividad de BCR-ABL, incluyendo la fosforilación de BCR-ABL, la fosforilación de la familia de cinasas Src como la cinasa Lyn, junto con la fosforilación de proteínas efectoras descendentes tales como CrkL y Stat5 a concentraciones comparables a las necesarias para inhibir la proliferación de la línea celular de la leucemia mieloide crónica. Bosutinib también inhibe la mayoría de los mutantes clínicamente relevantes de BCR-ABL que conducen a la resistencia al imatinib, sin embargo es ineficaz contra el mutante T315I. A diferencia de otros inhibidores de la cinasa Abl utilizados en la clínica, el bosutinib tiene una actividad mínima contra el receptor tirosina cinasas c-Kit y el receptor de PDGF.
ASPECTOS MOLECULARES
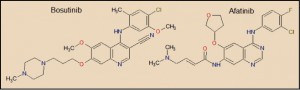
El bosutinib está relacionado farmacológicamernte con imatinib y otros miembros de la serie de inhibidores de las tirosina cinasas (TKI). Desde el punto de vista estructural, presenta una notable familiaridad química con afatinib.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas de la dulaglutida han sido suficientemente contrastadas en la indicación autorizada mediante un ensayo clínico de fase I/II abierto, multicéntrico y con único brazo de tratamiento a base bosutinib 500 mg/24 h (oral), realizado sobre un conjunto de 570 pacientes con leucemia mieloide crónica resistente al imatinib o con intolerancia a éste, que previamente habían sido tratados al menos con imatinib (eventualmente seguido de dasatinib o nilotinib), de los cuales 376 se encontraban en fase crónica (110 previamente tratados con dasatinib o nilotinib, además del imatibib), 69 en fase acelerada y 54 en fase blastica; los 70 restantes correspondían a pacientes con leucemia linfoblástica aguda tratados previamente.
La variable primaria de eficacia consistió en la tasa de respuesta citogenética mayor en la semana 24; el resto de variables clínicas consistieron en la duración la respuesta citogenética mayor, la respuesta hematológica y su duración, así como los porcentajes de pacientes con supervivencia sin progresión y supervivencia global. Posteriormente, se ha realizado un seguimiento a largo plazo (hasta más de cuatro años) de algunos de los pacientes incluidos en este estudio.
Los parámetros hematológicos consisten en la variación conseguida en las cantidades relativas de leucocitos y específicamente el porcentaje de células sanguíneas inmaduras (blastos). Por su parte, el análisis citogenético indica el porcentaje de células Ph+ presentes, mientras que a nivel molecular, se determina el número de células que poseen la mutación BCR-ABL. En general, las tasas de respuesta en la LMC se establecen en función de obtener una adecuada respuesta hematológica en las fases avanzadas de la enfermedad (fases acelerada y blástica) y una respuesta citogenética en la fase crónica. En concreto, una respuesta hematológica implica presentar menos células mieloides inmaduras de la sangre periférica, lo que viene indicado por una reducción de los leucocitos a los valores normales. La respuesta hematológica es completa si no se detectan células inmaduras (menos de un 5% de blastos) y los recuentos son normales en sangre periférica, mientras que es parcial si se detecta la presencia de menos del 50% de células inmaduras y de plaquetas con relación a antes del tratamiento. Igualmente, una respuesta citogenética puede ser mayor (0-34% células Ph+): completa (0% células Ph+) o parcial (1-34%), y menor (35-65% células Ph+). Los resultados encontrados fueron los siguientes:
- Respuesta citogenética mayor:
- Pacientes en fase crónica pretratados solo con imatinib (FCI): 59%
- Pacientes en fase crónica pretratados con imatinib + dasatinib ± nilotinib (FCI+DN): 41%
- Pacientes en fase acelerada pretratados con imatinib ± nilotinib ± nilotinib (FA): 35%
- Pacientes en fase blástica pretratados con imatinib ± nilotinib ± nilotinib (FB): 30%
- Respuesta citogenética completa: 48% (FCI); 32% (FCI+DN); 25% (FA); 20% (FB)
- Porcentaje de pacientes con respuesta citogenética mayor
- A un año: 77% (FCI); 74% (FCI+DN); 62% (FA); 7,9% (FB)
- A dos años: 77% (FCI); 71% (FCI+DN); ND2 (FA); ND (FB)
- Respuesta hematológica completa: 85% (FCI); 73% (FCI+DN); 35% (FA); 15% (FB)
- Tasa de supervivencia sin progresión:
- A un año: 91% (FCI); 78% (FCI+DN); 65% (FA); 14% (FB)
- A dos años: 81% (FCI); 75% (FCI+DN); ND (FA); ND (FB)
- Tasa de supervivencia global3:
- A un año: 97% (FCI); 91% (FCI+DN); 76% (FA); 44% (FB)
- A dos años: 91% (FCI); 84% (FCI+DN); ND (FA); ND (FB)
Desde el punto de vista de la seguridad en este estudio, los eventos adversos emergentes durante el tratamiento (duración media de 11,1 meses) en cada cohorte de pacientes fueron principalmente gastrointestinales: diarrea (FCI: 86%; FCI+DN: 83% y FA+FB: 74%), náuseas (46%; 48%; 48%] y vómitos (37%; 38%; 43%); la diarrea se presentó precozmente, aunque pocos (8%) pacientes la experimentaron de forma intensa (grado ≥3), obligando a una reducción de la dosis. Se reportó mielosupresión de grado 3/4 en el 41% de los pacientes; Entre los pacientes afectados, el 46% fueron tratados con interrupción de bosutinib y el 32% con reducción de dosis. TEAE elevación de la alanina aminotransferasa ocurrió en el 17% de los pacientes (grado 3/4, 7%); Entre los pacientes tratados con interrupción de la dosis, bosutinib rechallenge tuvo éxito en el 74%.
Las reacciones adversas notificadas más frecuentemente en ≥20% de los pacientes fueron diarrea (7%), náuseas (42,1%; 9,1% grado≥3), trombocitopenia (38,5%; 25,4), vómitos (37,1%), dolor abdominal (33,4%), erupción cutánea (32,4%; 6,1%), anemia (27,4%; 12,3%), pirexia (23,4%) y elevación de la concentración de alanina aminotransferasa (ALT) (22,3%; 10,2%). Otras reacciones adversas de grado ≥3 notificadas en ≥5% de los pacientes fueron neutropenia (11,5%), elevación de la concentración de lipasas (5,2%) y elevación de la concentración de aspartato aminotransferasa (AST) (5,0%). Un 1,1% de los pacientes experimentaron variaciones ≥60 segundos en el intervalo QT de electrocardiograma.
ASPECTOS INNOVADORES
Bosutinib es un agente antitumoral que forma parte del grupo de los inhibidores de la tirosina cinasa, actuando específicamente los receptores de tipo tirosina cinasa (RTK), como los de la proteína oncogénica BCR/ABL. Ha sido autorizado para su uso en el tratamiento de pacientes adultos con leucemia mieloide crónica con cromoso Philadelphia positivo, en fase crónica, fase acelerada o fase blástica, tratados previamente con uno o más inhibidores de la tirosina cinasa y para quienes imatinib, nilotinib y dasatinib no se consideran opciones adecuadas de tratamiento.
Su eficacia ha sido contrastada en un ensayo clínico abierto y de brazo único (sin comparadores) en un amplio grupo de pacientes con leucemia mieloide crónica, mayoritariamente en fase crónica, pero también con un número relevante de pacientes en fase avanzada y plástica. Pero lo más importante es que se trataba en todos los casos de pacientes intolerantes al imatinib o que refractarios al tratamiento con éste, e incluso también se incluyó a pacientes que, además del imatinib, presentaban cuadros resistentes al dasatinib y/o al nilotinib. Por tanto, grupos de pacientes de segunda (resistencia al imatinib), de tercera (imatinib más nilotinib o dasatinib) o cuarta línea de tratamiento (imatinib más dasatinib más nilotonib); en definitiva, pacientes con un margen de actuación terapéutica muy restringido.
La utilización del bosutinib produjo una respuesta citogenética mayor (0-34% células Ph+) a las 24 semanas en porcentajes de pacientes que van desde un 30% (pacientes en fase bastica pretratados con imatinib ± nilotinib ± nilotinib), 35% (fase acelerada pretratados con imatinib ± nilotinib ± nilotinib), 41% (fase crónica pretratados con imatinib + dasatinib ± nilotinib), hasta un 59% (fase crónica pretratados solo con imatinib), con respuestas citogenéticas completas del 20, 25, 32 y 48%, respectivamente. Asimismo, las tasas de respuesta hematológica completa (menos de un 5% de blastos y recuentos normales en sangre periférica) fueron, respectivamente, del 15, 35, 73 y 85% (FCI); todo ello, con tasas de supervivencia global a un año del 44, 76, 91 y 98%, respectivamente.
Aunque la documentación clínica es obviamente limitada, los datos sugieren que el bosutinib tiene un papel significativo en los pacientes con leucemia mieloide crónica que han fracasado en primera línea al imatinib e, incluso a los más modernos dasatanib/nilotonib administrados tras el imatinib. Sin embargo, cada vez hay más pruebas de que en los pacientes cuya enfermedad está controlada por estos fármacos tendrá un mayor impacto sobre su calidad de vida las comorbilidades y los efectos adversos de los fármacos utilizados que la propia enfermedad (Caldemeyer, 2016).
Desde la incorporación de imatinib en 2002, se han desarrollado cuatro inhibidores de tirosina cinasas (TKI) adicionales para tratar la leucemia mieloide crónica, incluyendo nilotinib, dasatinib y bosutinib (el ponatinib está en espera). A pesar de su importante impacto en la progresión de la enfermedad, hay un creciente reconocimiento de las toxicidades cardiovasculares que pueden limitar su uso a largo plazo y el impacto de la morbilidad y mortalidad del paciente. La mayoría de las cardiotoxicidades están asociadas con los TKI más recientes, siendo particularmente preocupantes los eventos vasculares (infarto de miocardio, accidente cerebrovascular y enfermedad arterial periférica). Además, también se observan la prolongación del intervalo QT, los derrames pleurales y la hipertensión sistémica y pulmonar (Damrongwatanasuk, 2017).
Aunque el bosutinib no ha mostrado por el momento una particular cardiotoxocidad, es importante mantener la guardia alta, tanto por los cardiólogos como los oncólogos, sobre estas cuestiones con el fin de desarrollar estrategias adecuadas de monitorización y reducción del riesgo para prevenir estas toxicidades y evitar el cese prematuro del tratamiento. Con todo, debe considerarse al bosutinib un paso más en la mejorar de la supervivencia de los pacientes con leucemia mieloide crónica refractaria a tratamientos previos.
|
VALORACIÓN |
|
BOSUTINIB
|
|
Grupo Terapéutico (ATC): L01XE. AGENTES ANTINEOPLÁSICOS E INMUNOMODULADORES. Inhibidores directos de la proteína cinasa |
|
Indicaciones autorizadas: Tratamiento de pacientes adultos con leucemia mieloide crónica con cromoso Philadelphia positivo, en fase crónica, fase acelerada o fase blástica, tratados previamente con uno o más inhibidores de la tirosina cinasa y para quienes imatinib, nilotinib y dasatinib no se consideran opciones adecuadas de tratamiento. |
|
INNOVACIÓN MODERADA. Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar |
|
FÁRMACOS RELACIONADOS REGISTRADOS EN ESPAÑA |
|||
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Imatinib |
Glivec |
Novartis |
2002 |
|
Erlotinib |
Tarceva |
Roche |
2006 |
|
Sunitinib |
Sutent |
Pfizer |
2007 |
|
Dasatinib |
Sprycel |
Bristol Myers Squibb |
2007 |
|
Sorafenib |
Nexavar |
Bayer |
2007 |
|
Lapatinib |
Tyverb |
Glaxo |
2008 |
|
Nilotinib |
Tasigna |
Novartis |
2008 |
|
Gefitinib |
Iressa |
AstraZeneca |
2010 |
|
Pazopanib |
Votrient |
Glaxo |
2011 |
|
Crizotinib |
Xalkori |
Pfizer |
2014 |
|
Vemurafenib |
Zelboraf |
Roche |
2014 |
|
Dabrafenib |
Tafinlar |
GlaxoSmithKline |
2014 |
|
Axitinib |
Inlyta |
Pfizer |
2014 |
|
Afatinib |
Giotrif |
Boehringer Ingelheim |
2014 |
|
Ruxolitinib |
Jakavi |
Novartis |
2015 |
|
Vandetanib |
Caprelsa |
AstraZeneca |
2015 |
|
Regorafenib |
Stivarga |
Bayer |
2015 |
|
Nintedanib |
Ofev |
Boehringer Ingelheim |
2015 |
|
Ibrutinib |
Imbruvica |
Janssen Cilag |
2016 |
|
Trametinib |
Mekinist |
Novartis |
2016 |
|
Cobimetinib |
Cotellic |
Roche |
2016 |
|
Bosutinib |
Bosulif |
Pfizer |
2017 |
BIBLIOGRAFÍA
Bibliografía
- Caldemeyer L, Dugan M, Edwards J, Akard L. Long-Term Side Effects of Tyrosine Kinase Inhibitors in Chronic Myeloid Leukemia. Curr Hematol Malig Rep. 2016; 11(2): 71-9. doi: 10.1007/s11899-016-0309-2.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Damrongwatanasuk R, Fradley MG. Cardiovascular Complications of Targeted Therapies for Chronic Myeloid Leukemia. Curr Treat Options Cardiovasc Med. 2017; 19(4): 24. doi: 10.1007/s11936-017-0524-8.
- European Medicines Agency (EMA). Bosulif®. European Public Assessment Report (EPAR). EMA/42251/202013; EMEA/H/C/002373. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002373/WC500141745.pdf
- Gambacorti-Passerini C, Brümmendorf TH, Kim DW, Turkina AG, Masszi T, Assouline S, et al. Bosutinib efficacy and safety in chronic phase chronic myeloid leukemia after imatinib resistance or intolerance: Minimum 24-month follow-up. Am J Hematol. 2014; 89(7): 732-42. doi: 10.1002/ajh.23728.
- Gambacorti-Passerini C, Kantarjian HM, Kim DW, Khoury HJ, Turkina AG, Brümmendorf TH, et al. Long-term efficacy and safety of bosutinib in patients with advanced leukemia following resistance/intolerance to imatinib and other tyrosine kinase inhibitors. Am J Hematol. 2015; 90(9): 755-68. doi: 10.1002/ajh.24034.
- Kantarjian HM, Cortes JE, Kim DW, Khoury HJ, Brümmendorf TH, Porkka K, et al. Bosutinib safety and management of toxicity in leukemia patients with resistance or intolerance to imatinib and other tyrosine kinase inhibitors. Blood. 2014; 123(9): 1309-18. doi: 10.1182/blood-2013-07-513937.
- Khoury HJ, Cortes JE, Kantarjian HM, Gambacorti-Passerini C, Baccarani M, Kim DW, et al. Bosutinib is active in chronic phase chronic myeloid leukemia after imatinib and dasatinib and/or nilotinib therapy failure. Blood. 2012; 119(15): 3403-12. doi: 10.1182/blood-2011-11-390120.
- Novelli Canales S, García Cadenas I. Terapéutica farmacológica de los cánceres hematológicos. En: Terapéutica farmacológica de los trastornos neoplásicos e inmunológicos. Consejo General de Colegios Oficiales de Farmacéuticos. Madrid; 2011. p. 189-220.
1 El trasplante de medula ósea en pacientes con leucemia mieloide crónica está limitado por la necesidad de un donante con concordancia en el antígeno de los leucocitos humanos (HLA), así como por la edad del paciente, ya que los más jóvenes responden significativamente mejor que aquellos de más edad.
2 No determinado.
3 Incluye todas las muertes, con independencia de la causa.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares





