Alogliptina Vipidia® (Takeda)
 Nº388
Nº388
Resumen
La alogliptina es un agente antidiabético oral autorizado para el tratamiento de adultos con diabetes mellitus tipo 2 a partir de los 18 años de edad, para mejorar el control glucémico en combinación con otros medicamentos hipoglucemiantes, incluida la insulina, cuando estos, junto con dieta y ejercicio, no proporcionan un control glucémico adecuado. El fármaco actúa como un inhibidor selectivo del enzima dipeptidil peptidasa de tipo 4 (DPP-4), implicado en la inactivación de hormonas incretinas. De esta manera, es capaz de incrementar la concentración y la duración de la actividad de estas hormonas. Está estrechamente relacionado, tanto estructural como farmacológicamente, con otros inhibidores de la DPP-4 previamente comercializados (linagliptina, saxagliptina, sitgliptina y vildagliptina).
DIABETES MELLITUS
DE TIPO 2
La diabetes mellitus (DM) comprende un grupo de enfermedades metabólicas caracterizadas por la persistencia de hiperglucemia (niveles elevados de glucosa en sangre), y aparece como consecuencia de defectos en la secreción y/o en la acción de la insulina. La hiperglucemia crónica se asocia con lesiones a largo plazo en diversos órganos, particularmente en ojos, riñón, nervios, piel, vasos sanguíneos y corazón.
El valor normal de la glucemia tras un ayuno de 8 h es de 70 a 110 mg/dL, por lo que los valores que se encuentran entre 110 y 125 mg/dL se consideran como estados prediabéticos (alteración de la glucosa en ayunas o glucosa basal alterada; al igual que valores entre 140-200 mg/dL, a las 2 horas de la sobrecarga oral de glucosa, es decir, alteración de la tolerancia a la glucosa o intolerancia a la glucosa). En estos estados, si bien el riesgo microangiopático es igual al del individuo sano normoglucémico, el riesgo cardiovascular es mayor y, con el tiempo, existe la posibilidad de conversión a diabetes mellitus de tipo 2 (Escalada, 2013). En definitiva, los criterios para el diagnóstico de diabetes mellitus son los siguientes: niveles de glucemia en ayunas ≥ 126 mg/dL (7,0 mmol/L), o ≥ 200 mg/dL (11,1 mmol/L) a las 2 horas durante la realización de un test de tolerancia oral a la glucosa, o síntomas de hiperglucemia (poliuria, polidipsia o pérdida inexplicada de peso) junto con una determinación casual (cualquier momento del día sin tener en cuenta el periodo de tiempo después de la última comida) de glucemia ≥ 200 mg/dL (11,1 mmol/L), o porcentajes de hemoglobina glucosilada A1c (HbA1c) superiores al 6,5%.
Básicamente, la diabetes se desdobla en los siguientes tipos:
- Diabetes mellitus de tipo 1 (DM1), de etiología autoinmune, traumática o idiopática. En este tipo de diabetes hay una pérdida completa o mayoritaria de las células que producen insulina en el páncreas.
- Diabetes mellitus de tipo 2 (DM2), donde hay una combinación de la resistencia al efecto de la insulina en los tejidos, con una sobreproducción inicial de ésta (aunque insuficiente para cubrir las mayores necesidades derivadas de la resistencia); con el paso del tiempo, la producción de insulina puede disminuir ante el fallo del páncreas por mantener la sobreproducción. Es la forma más común de diabetes, hasta el punto de que supone en torno al 90% de todos los casos de diabetes en la Unión Europea.
- Diabetes mellitus gestacional (DMG), inducida por el desarrollo del embarazo. Una hiperglucemia persistente durante el embarazo aumenta las probabilidades de que el bebé nazca prematuro, presente un peso anómalo (por defecto o por exceso), o tenga hipoglucemia u otros problemas de salud al nacer (dismorfogénesis); asimismo, puede aumentar el riesgo de aborto espontáneo o de muerte fetal. No obstante, las mujeres con diabetes pueden tener bebés completamente sanos, siempre que se controlen su glucemia antes y durante el embarazo. Si lo hacen, el riesgo de defectos de nacimiento es prácticamente el mismo que en los bebés nacidos de mujeres que no tienen diabetes.
- Otros tipos específicos, generalmente asociados a defectos genéticos que afectan a la función de las células beta pancreáticas, o la acción de la insulina, asociada a alteraciones del páncreas exocrino, a endocrinopatías, a infecciones, a síndromes genéticos, o inducida por fármacos.
Según la Fundación para la Diabetes, la diabetes es uno de los mayores desafíos de la salud y el desarrollo del siglo XXI. Actualmente hay 371 millones de personas que viven con diabetes y de espera que 500 millones de personas vivan con diabetes en 2030. En España, la Federación de Diabéticos Españoles estima la diabetes afecta a 5.300.000 personas; es decir, más del 14% de la población española, aunque el 6% aún lo desconoce (FEDE, 2015). El porcentaje de afectados crece un 5 por ciento anual, siendo Canarias y Murcia las comunidades españolas con mayor proporción de diabéticos entre la población.
La diabetes de tipo 2 (DM2) se ha convertido en uno de los problemas sanitarios más graves de nuestro tiempo. Por otro lado, resulta alarmante el aumento de la prevalencia de la DM2 en niños y adolescentes, probablemente por el aumento del sobrepeso, estimándose en que en estas edades la prevalencia de los nuevos casos es del 45%. Por otro lado parece que tan solo un 30-40% de los diabéticos en tratamiento consigue el control metabólico, lo que hace que la morbimortalidad sea de tres a cuatro veces mayor en los pacientes con DM2 que en la población en general.
El estudio di@bet.es (Soriguer, 2012) analizó la prevalencia de diabetes y de alteraciones del metabolismo glucídico en España, concluyendo que casi el 30% de la población española tenía alguna alteración metabólica relacionada con los glúcidos (hidratos de carbono). En concreto, la prevalencia global de la diabetes mellitus ajustada por edad y sexo fue de 13,8% (IC95% 12,8 a 14,7%), de los cuales aproximadamente la mitad desconocía su diabetes (6.0%; IC95% 5,4 a 6.7%). La tasas de prevalencia ajustados por sexo correspondientes a la alteración de la glucemia en ayunas eran del 3,4% (IC95% 2,9 a 4,0%), las de intolerancia a la glucosa eran del 9,2% (IC95% 8,2 a 10,2%), y la combinación de ambas del 2,2% (IC95% 1,7 a 2,7%). La prevalencia de la diabetes y la regulación de la glucosa aumenta significativamente con la edad (p <0,0001), y es mayor en hombres que en mujeres (p <0,001). En general, en la mayoría de los países europeos, la prevalencia de la diabetes y de intolerancia a la glucosa es moderada o baja (<10% en personas menores de 60 años y 10 a 20% en personas de 60 a 80 años).
En el caso particular de la diabetes de tipo 2 (DM2), los resultados del estudio di@bet.es sitúan la prevalencia total de la DM2 en el 12% (de los que el 3,9% era desconocida para los pacientes). Adicionalmente, se detecta una prevalencia de obesidad del 28,2%, de hipertensión arterial del 41,2%, de síndrome metabólico del 20,8% y de sedentarismo del 50,3%. En este sentido, en relación a la relación entre la diabetes tipo 2 y el resto de factores de riesgo, el estudio confirmó la asociación ente diabetes, obesidad e hipertensión arterial (ambas duplican el riesgo de diabetes); el determinante papel del nivel de estudios, tanto para el riesgo de ser obeso (no tener estudios cuadruplica el riesgo frente a tener estudios universitarios), como diabético o hipertenso (no tener estudios duplica el riesgo en ambos casos); la importancia de la actividad física (las personas que no hacen ejercicio en su tiempo libre tienen un 50% más de posibilidades de ser obesas, y las personas obesas y con diabetes hacen la mitad de ejercicio que las personas delgadas o sin diabetes). Finalmente, es destacable la existencia de una proporción significativa de personas con diabetes que desconocían serlo (casi el 4% de la población). En definitiva, la diabetes tipo 2 (DM2) se ha convertido en uno de los problemas sanitarios más graves de nuestro tiempo. Sus proporciones son ya epidémicas en la mayor parte del mundo, estimándose que actualmente existen 246 millones de personas afectadas en todo el planeta, pudiendo llegar a los 380 millones en el año 2025 si se cumplen las últimas predicciones.
La diabetes mellitus de tipo 1 (DM1) es causada por la destrucción – debida, mayoritariamente, a un ataque autoinmune o a la extirpación – de las células β-pancreáticas, siendo por tanto la reserva insulínica nula o escasa; mientras que la DM2 se debe a diversos grados de resistencia a la acción de la insulina, a una secreción insuficiente de ésta, o a ambas circunstancias al mismo tiempo; también es frecuente en este tipo de diabetes una sobreproducción hepática de glucosa. Asís pues, la resistencia a la insulina es un componente fundamental de la DM2, por la que está alterado el balance entre la secreción de insulina por las células β y la acción periférica de la insulina en tejidos periféricos. Muchos obesos inicialmente tienen resistencia a la insulina y no desarrollan DM2; sin embargo, con el tiempo, las alteraciones en la secreción de insulina por las células β determinarán su aparición. En la DM2 parece existir un defecto programado de la secreción de insulina; en este sentido, cabe recordar que fisiológicamente hay una producción constante de insulina a lo largo de 24 horas – insulina basal – que está acompañada por picos bruscos de mayor producción para cubrir las necesidades metabólicas derivadas de la digestión de las comidas (Cuéllar, 2012).
La hiperglucemia permanente es la responsable principal de las complicaciones más comunes de la diabetes a largo plazo: retinopatía, nefropatía y neuropatía, debido fundamentalmente a que las algunas de las proteínas presentes en la sangre y en el interior de las células sufren un proceso de glucosilación; es decir, la progresiva incorporación de moléculas de glucosa sobre la estructura peptídica. Esta glucosilación altera las características físicas y químicas de dichas proteínas y, en definitiva, su actividad biológica. La consecuencia es el deterioro acumulado de algunas funciones fisiológicas, especialmente relacionadas con el mantenimiento de la homeostasis interna y con los vasos sanguíneos, muy especialmente los de pequeño calibre y en particular los capilares; de hecho, de ahí derivan la buen parte de las complicaciones a largo plazo de la DM.
Adicionalmente, un estado de hiperglucemia prolongado conduce a la activación y/o sobreutilización de vías metabólicas alternativas para la glucolisis que dan lugar a metabolitos que acaban por acumularse provocando diversas alteraciones; éste es el caso de la neuropatía diabética, asociada a un deterioro de la capa mielínica de las conducciones nerviosas periféricas.
El nivel de glucosilación de la hemoglobina, es decir, la proporción de hemoglobina glucosilada (HbA1c) se considera el mejor marcador biológico de los riesgos crónicos asociados a la diabetes y, de hecho, hay datos robustos que demuestran que la disminución del porcentaje de hemoglobina glucosilada mejora el pronóstico de los pacientes diabéticos y disminuye el riesgo a sufrir enfermedades micro y macrovasculares.
Teniendo en cuenta todo lo anterior, el objetivo general del tratamiento de la diabetes mellitus consiste en la consecución de un buen control metabólico de la glucemia, con el fin de evitar o retrasar la aparición de las complicaciones agudas y crónicas, tanto en pacientes con DM1 como con DM2. No obstante, si el control estricto de la glucemia se realiza en pacientes con una diabetes muy evolucionada, con complicaciones avanzadas o con patologías asociadas graves, no solo no se consigue una mayor prevención cardiovascular, sino que la mortalidad puede incluso aumentar.
Por consiguiente, el primer objetivo de la terapia antidiabética es alcanzar y mantener las cifras estables de glucemia tan próximas como sea posible al rango de los no diabéticos. Asimismo, el control de la presión arterial y de la lipemia son factores fundamentales en la reducción del riesgo cardiovascular, hasta el punto de que pequeños logros en estos objetivos tienen una repercusión importante en la morbilidad y mortalidad cardiovascular. En cualquier caso el principal marcador biológico que permite establecer una relación con la evolución de la enfermedad es la tasa (%) de hemoglobina glucosilada o hemoglobina A1c (HbA1c). En este sentido, las recomendaciones terapéuticas actuales definen los siguientes objetivos:
- Conseguir un valor de HbA1c inferior al 7% ha demostrado reducir las complicaciones microvasculares de la diabetes. Además, es importante conseguir este objetivo pronto tras el diagnostico de diabetes, puesto que también se asocia a una reducción a largo plazo de eventos macrovasculares; es decir, un buen control temprano de la glucemia tiene efectos años después (“memoria metabólica”).
- Se puede establecer un objetivo más ambicioso (HbA1c<6,5%) para determinados pacientes, si se puede conseguir sin provocar hipoglucemias significativas u otros efectos adversos del tratamiento. Los pacientes más apropiados serían aquellos con una duración corta de la enfermedad, edad menor de 70 años, ausencia de complicaciones microvasculares significativas, larga expectativa de vida y sin enfermedad cardiovascular significativa.
- Por otra parte, también hay pacientes en los que se deberían establecer objetivos menos ambiciosos (HbA1c<7,5%), particularmente aquellos con historia de hipoglucemias graves, expectativa de vida limitada, complicaciones micro- o macrovasculares avanzadas, comorbilidad importante, y aquellos con una larga duración de su diabetes en los que es difícil alcanzar el objetivo general a pesar de una adecuada educación diabeto lógica, un adecuado programa de monitorización glucémica y el uso de dosis eficaces de múltiples antidiabéticos, incluyendo la insulina.
No puede olvidarse que la hiperglucemia es un factor de riesgo cardiovascular más en el paciente con diabetes, y que existen otros factores de riesgo asociados, como dislipemia, hipertensión, obesidad o tabaquismo. Estos van a condicionar, en gran parte, la posible aparición de complicaciones y la supervivencia del paciente. Por ello, se recomienda explícitamente el control de estos factores complementarios de riesgo, ya que esta aproximación terapéutica ha demostrado ser muy eficaz. En particular, la importancia del control del peso corporal en los pacientes con diabetes de tipo 2 o con síndrome metabólico está siendo cada vez más resaltada (Garber, 2012), por los efectos deletéreos que produce la obesidad y el sobrepeso sobre el propio control metabólico y las complicaciones cardiovasculares.
Según el Documento de consenso promovido por la Sociedad Española de Diabetes (Menéndez, 2010), una vez instaurados los cambios en el estilo de vida, el objetivo del tratamiento farmacológico de la DM2 es conseguir un control metabólico optimizado con la máxima seguridad posible, debiéndose plantear como objetivo más ambicioso el de una HbA1c<6,5% en las primeras fases de la enfermedad y el más pragmático del <7,5% en fases más avanzadas o con riesgo de hipoglucemias.
El tratamiento se divide en varios escalones terapéuticos. En el primero, y si la hiperglucemia no es excesiva (HbA1c: 6,5-8,5%), la metformina es el fármaco de elección. Sólo en casos de intolerancia o contraindicación se recomienda usar otros fármacos alternativos. Si la hiperglucemia es elevada (HbA1c> 8,5%), el tratamiento inicial debe realizarse de entrada con varios fármacos orales en combinación o bien iniciar el uso de insulina. El segundo escalón consiste en la adición de un segundo fármaco de acción sinérgica, para lo que se dispone de diversas opciones que deben individualizarse en función de las características de cada paciente. Finalmente, el tercer escalón implica la introducción de insulina basal como opción preferente frente a la triple terapia oral, que se reservará sólo para los casos de resistencia a la insulinización; un cuarto escalón (la incorporación de un cuarto agente antidiabético) solo tiene, por el momento, la consideración de terapia experimental.
A pesar de todo, se estima que más del 40% de los pacientes con DM2 no alcanzan los objetivos terapéuticos previstos, por lo que es necesario disponer del mayor número posible de estrategias farmacológicas capaces de facilitar la consecución de dichos objetivos. En este sentido, las opciones farmacológicas actualmente disponibles para tratar la DM2 consisten en:
- Aporte exógeno de insulina o de análogos insulínicos.
- Aumento de la sensibilidad a la insulina endógena:
- Biguanidas: metformina.
- Activadores del receptor hormonal nuclear PPARγ o receptor gamma activado por el proliferador de peroxisomas (Tiazolidindionas): pioglitazona, rosiglitazona.
- Aumento de la secreción/liberación de insulina endógena:
- Sulfonilureas: glibenclamida, gliclazida, glimepirida, glipizida, gliquidona, glisentida.
- Metiglinidas y análogos: nateglinida, repaglinida.
- Incretinomiméticos
- Agonistas del receptor de GLP-1 (Glucagon-like peptide 1; péptido 1 similar al glucagón), ArGLP-1: albiglutida, exenatida, liraglutida, lixisenatida.
- Inhibidores de la dipeptidilpeptidasa-4 (iDPP-4): alogliptina, linagliptina, saxagliptina, sitagliptina, vildagliptina.
- Reducción de la absorción digestiva de glucosa:
- Inhibidores de las α-glucosidasas: acarbosa, miglitol.
- Fibra vegetal y derivados: goma guar, etc.
- Inhibición de la reabsorción tubular renal de glucosa:
- Inhibidores del SGLT2 o cotransportador de sodio y glucosa: canagliflozina, dapagliflozina, empagliflozina.
ACCIÓN Y MECANISMO
La alogliptina es un agente antidiabético oral autorizado para el tratamiento de adultos con diabetes mellitus tipo 2 a partir de los 18 años de edad, para mejorar el control glucémico en combinación con otros medicamentos hipoglucemiantes, incluida la insulina, cuando estos, junto con dieta y ejercicio, no proporcionan un control glucémico adecuado.
El fármaco actúa como un inhibidor selectivo del enzima dipeptidil peptidasa de tipo 4 (DPP-4), implicado en la inactivación de hormonas incretinas. De esta manera, es capaz de incrementar la concentración y la duración de la actividad de estas hormonas. Las incretinas son una familia de hormonas que son liberadas en el intestino de forma continua a lo largo del día, siendo incrementados sus niveles en respuesta a la presencia de comida. Entre las incretinas, cabe citar al GLP-1 (péptido similar al glucagón, 1) o el GIP (péptido insulinotrópico dependiente de la insulina). Las incretinas forman parte de un sistema endógeno implicado en la regulación fisiológica de la homeostasis de la glucosa. Cuando la glucemia es normal o está por encima de los valores fisiológicos, GLP-1 y GIP provocan un incremento de la síntesis y liberación de insulina por parte de las células beta de los islotes de Langerhans, del páncreas. Adicionalmente, el GLP-1 reduce la secreción de glucagón – la principal hormona hiperglucemiante – en las células alfa pancreáticas. La combinación del incremento de los niveles de insulina con una reducción de los correspondientes al glucagón, conduce a una reducción de la producción hepática de glucosa, lo cual se traduce en una reducción efectiva de la glucemia. Por el contrario, cuando el estado existente es de hipoglucemia, no se produce ninguna estimulación de la liberación de insulina ni supresión de la de glucagón, por lo que no se bloquea la respuesta de este último para contrarrestar fisiológicamente la hipoglucemia. Sin embargo, la actividad de estas incretinas está limitada fisiológicamente por el enzima DPP-4, que las hidroliza de forma muy rápida. El hecho de que la actividad biológica del GLP-1 cese cuando la glucemia desciende por debajo de 55 mg/dl hace que el efecto inhibidor de la DPP-4 (y, por consiguiente, el alargamiento de la vida útil del GLP-1) no plantee riesgos significativos de hipoglucemia excesiva.
La inhibición de la DPP-4 es muy selectiva, ya que la linagliptina es más de 9.000 veces más activa sobre esta isoforma que sobre otras dipeptidilpeptidasas (como la DPP-8 o la DPP-9), tal como ocurre con la linagliptina y otros inhibidores de la DPP-4. La potencia inhibidora media in vitro de la alogliptina sobre este enzima está en torno a 7 nmol/L – expresado como concentración inhibitoria para el 50% (IC50%) –, en el mismo rango que la sitagliptina (10), vildagliptina (5), saxagliptina (3) y linagliptna (1).
Una única dosis de alogliptina es capaz de bloquear la actividad de la DPP-4 entre un 65% (dosis de 6,25 mg) y un 97% (dosis de 800 mg) durante 24 h, con valores intermedios del 74% (dosis de 25 mg) y 94% (dosis de 200 mg); los correspondientes porcentajes de bloqueo a las 72 horas posdosis fueron del 28% (6,25 mg), 48% (25 mg) 74% (200 mg) y 83% (800 mg).
En definitiva, la acción de la alogliptina se traduce en un incremento de los niveles y de la duración de la actividad de las incretinas, incrementando la liberación de insulina y reduciendo los niveles de glucagón en la sangre, de una forma dependiente de la glucemia. Tras la administración oral de glucosa o de comida, la inhibición de la DPP-4 se traduce en un incremento de dos a tres veces en los niveles sanguíneos de GLP-1 y GIP, reduciendo los de glucagón e incrementando la respuesta de hiperinsulinémica a la glucosa, provocando un aumento de los niveles de péptido C y de insulina. Todo ello se asocia con una menor glucemia en ayunas y una menor respuesta hiperglucemiante tras las comidas.
ASPECTOS MOLECULARES
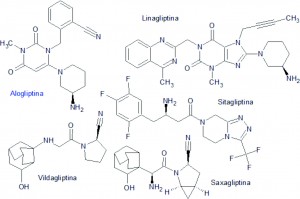
La alogliptina es un inhibidor selectivo de la dipeptidil peptidasa 4 (DPP-4), que actúa fraccionando a las hormonas incretinas, como la GLP-1 y la GIP, mediante la rotura de la cadena peptídica a nivel de los aminoácidos prolina o alanina situados en penúltima posición con respecto al N-terminal (posición P-1). La alogliptina mantiene una estrecha relación química y farmacológica con otros inhibidores de la dipeptidil peptidasa 4 (DPP-4), aunque especialmente con la linagliptina. Todas ellas se caracterizan por presentar una estructura que incluye un agrupamiento que emula la estructura del aminoácido prolina, actuando como un falso sustrato de la dipeptidilpeptidasa 4 (DPP-4), provocando el bloqueo de ésta.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas de la alogliptina han sido adecuadamente contrastadas en las indicaciones autorizadas mediante seis ensayos clínicos de fase 3 (confirmatorios de eficacia y seguridad), aleatorizados, multicéntricos, doblemente ciegos y controlados con placebo y dos utilizando tratamientos activos (glipizida, pioglitazona). En concreto, se dispone de ensayos clínicos en monoterapia en pacientes con diabetes mellitus de tipo 2 (DM2) inadecuadamente controlados solo con dieta y ejercicio, así como tratamiento adicional (add-on) a otros tratamientos antidiabéticos que venían siendo utilizados previamente (insulina, metformina, glipizida, pioglitazona) por los pacientes estudiados, que no estaban adecuadamente controlados; en cualquier caso, todos los pacientes incluidos en los ensayos clínicos de fase 3 presentaban valores basales (al comienzo del estudio) de hemoglobina glucosilada (HbA1C) entre 7 y 10%.
La variable primaria de eficacia utilizada en estos estudios fue la variación experimentada en las tasas de hemoglobina glucosilada (HbA1c) desde el inicio hasta el final del estudio; se utilizaron habitualmente como variables secundarias la variación de la glucemia en ayunas, el porcentaje de pacientes con HbA1C 7,0% y la variación del peso corporal, entre otras.
Los estudios tuvieron una duración que osciló entre 12 y 52 semanas, totalizando 5675 pacientes aleatorizados, utilizándose dosis de 12,5 y 25 mg/24 h de alogliptina, por vía oral, a excepción del estudio controlado con pioglitazona, en el que solo se utilizó la dosis de 25 mg/24 h de aplogliptina.
De los cinco ensayos clínicos pivotales de fase 3 controlados con placebo, finalizaron los estudios un 73% de los 2234 que fueron inicialmente incluidos; sus características demográficas, antropométricas y clínicas medias fueron: 53-57 años de edad (19% mayores de 64 años), 52% varones, 66-80% de raza blanca/caucásica, 1,5 a 13 años de duración media de la diabetes mellitus de tipo 2 (DM2), una tasa de hemoglobina glucosilada (HbA1C) en torno a 8% (salvo en el estudio realizado en adición a insulina, que fue del 9,3%) y un índice de masa corporal (IMC) de 30-33 kg/m2.
En los dos ensayos clínicos pivotales de fase 3 controlados con comparadores activos, finalizaron los estudios un 71% de los 3341 inicialmente incluidos; sus características fueron: 54-56 años de edad (18% mayores de 64 años), 50% varones, 60-64% de raza blanca/caucásica, 5,5 a 7,2 años de duración media de la DM2, una tasa de hemoglobina glucosilada (HbA1C) de 7,6% a 8,2%, y un índice de masa corporal (IMC) de 31-32 kg/m2.
Desde el punto de vista de la seguridad, la alogliptina presenta un perfil toxicológico equiparable al de otros agentes inhibidores de la DPP-4, con frecuentes eventos adversos aunque generalmente leves o moderados, transitorios y tratables fácilmente. Los eventos adversos relacionados con el tratamiento más frecuentemente descritos fueron cefalea (5,1% vs. 5,0% con los comparadores activos – glipizida y pioglitazona – vs. 3,8% con placebo), infecciones del tracto respiratorio superior (5,0 vs. 4,2 vs. 4,5%), nasofaringitis (5,3 vs. 4,4 vs. 4,4%), infecciones del tracto urinario (4,2 vs. 4,1 vs. 4,4%), hipertensión (3,7 vs. 4,5 vs. 3,3%) e hipoglucemia (0,4 vs. 3,5 vs. 0,0%). La incidencia de eventos adversos que condujeron a la descontinuación del tratamiento fue del 3,6% (alogliptina 12,5 mg), 4,1% (alogliptina 25 mg), 5,8% (comparadores activos) y 2,3% con placebo; por su parte, la incidencia de eventos adversos graves relacionados con el tratamiento fue del 4,0%, 4,7%, 5,2% y 3,2%, respetivamente.
La incidencia de eventos adversos graves asociados con alteraciones cardiacas fue comparable entre alogliptina 25 mg (1,0%) y los comparadores activos (1,2%), pero superior a la del placebo (0,4%). En este sentido, sin embargo, un amplio metanálisis (Monami, 2015) realizado sobre 84 ensayos clínicos con inhibidores de DPP-4 (incluyendo a alogliptina) ha mostrado que estos fármacos incrementan en un 19% el riesgo de insuficiencia cardiaca aguda (RR=1,19; IC95% 1,03 a 1,37; p=0,015), aunque no se han encontrado diferencias entre los fármacos de este grupo.
|
Tabla 1. Estudios clínicos de fase 3 con alogliptina controlados con placebo |
|||||
|
Indicación |
Monoterapia |
Adición a |
Adición a |
Adición a |
Adición a insulina ± metformina |
|
Pacientes |
329 |
500 |
527 |
493 |
390 |
|
Duración estudio |
26 semanas |
26 semanas |
26 semanas |
26 semanas |
26 semanas |
|
Tipo de estudio |
Doble ciego |
Doble ciego |
Doble ciego |
Doble ciego |
Doble ciego |
|
Edad (media) |
53 años |
57 años |
55 años |
55 años |
55 años |
|
Sexo (% varones) |
53% |
52% |
50% |
58% |
41% |
|
Duración DM2 |
2,0 años |
6,3 años |
5,0 años |
6,3 años |
11,9 años |
|
HbA1C (media; %) |
7,9% |
8,1% |
7,9% |
8,0% |
9,3% |
|
IMC (media; kg/m2) |
32,0 |
30,0 |
32,0 |
33,2 |
32,4 |
|
Determinación de la variable primaria |
26 semanas |
26 semanas |
26 semanas |
26 semanas |
26 semanas |
|
Variación HbA1C (%), en puntos porcentuales, con respecto al placebo |
Alogliptina (12.5): -0,54 Alogliptina (25): -0,57 |
Alogliptina (12.5): -0,39 Alogliptina (25): -0,53 |
Alogliptina (12.5): -0,50 Alogliptina (25): -0,48 |
Alogliptina (12.5): -0,47 Alogliptina (25): -0,61 |
Alogliptina (12.5): -0,54 Alogliptina (25): -0,57 |
|
% pac. HbA1C <7,0% |
Alogliptina (12,5): 47,4% Alogliptina (25): 44,3% Placebo: 23,4% |
Alogliptina* (12,5): 29,6% Alogliptina (25): 34,8% Placebo: 18,2% |
Alogliptina (12,5): 51,6% Alogliptina (25): 44,4% Placebo: 18,3% |
Alogliptina (12,5): 44,2% Alogliptina (25): 49,2% Placebo: 34,0% |
Alogliptina* (12,5): 8,4% Alogliptina* (25): 7,8% Placebo: 0,8% |
|
Variación glucemia ayunas (mmol/L) |
Alogliptina (12,5): -0,57 Alogliptina (25): -0,91 Placebo: +0,63 |
Alogliptina* (12,5): -0,26 Alogliptina* (25): -0,46 Placebo: +0,12 |
Alogliptina (12,5): -1,04 Alogliptina (25): -0,96 Placebo: +0,00 |
Alogliptina (12,5): -1,09 Alogliptina (25): -1,10 Placebo: -0,32 |
Alogliptina* (12,5): +0,13 Alogliptina (25): -0,65 Placebo: +0,32 |
|
Variación peso (kg) |
Alogliptina* (12,5): -0,09 Alogliptina* (25): -0,22 Placebo:+0,18 |
Alogliptina (12,5): +0,60 Alogliptina (25): +0,68 Placebo:-0,20 |
Alogliptina* (12,5): -0,39 Alogliptina* (25): -0.67 Placebo:-0,39 |
Alogliptina* (12,5): +1,46 Alogliptina* (25): +1,09 Placebo:+1,04 |
Alogliptina* (12,5): +0,68 Alogliptina* (25): +0,60 Placebo:+0,63 |
|
Referencia |
DeFronzo, 2008 |
Pratley, 2009 |
Nauck, 2009 |
Pratley, 2009 |
Rosenstock, 2009 |
Nota: Todas las diferencias entre los datos correspondientes a la alogliptina y los del placebo fueron estadísticamente significativas (p<0,05), salvo aquellas notadas con un asterisco (*).
Aunque la frecuencia de cuadros de pancreatitis asociados al tratamiento con alogliptina es bajo, parece ser mayor que el de los comparadores activos. De hecho, se han descrito varios casos de pancreatitis tras la autorización del medicamento (EMA; EPAR, 2013), al uno de los cuales resultó fatal.
ASPECTOS INNOVADORES
La alogliptina es un agente antidiabético oral autorizado para el tratamiento de adultos con diabetes mellitus tipo 2 a partir de los 18 años de edad, para mejorar el control glucémico en combinación con otros medicamentos hipoglucemiantes, incluida la insulina, cuando estos, junto con dieta y ejercicio, no proporcionan un control glucémico adecuado. El fármaco actúa como un inhibidor selectivo del enzima dipeptidil peptidasa de tipo 4 (DPP-4), implicado en la inactivación de hormonas incretinas. De esta manera, es capaz de incrementar la concentración y la duración de la actividad de estas hormonas. Está estrechamente relacionado, tanto estructural como farmacológicamente, con otros inhibidores de la DPP-4 previamente comercializados (linagliptina, saxagliptina, sitgliptina y vildagliptina).
Ha mostrado su utilidad en pacientes con diabetes mellitus tipo 2, produciendo una reducción estadísticamente significativa (tras seis meses de tratamiento) de 0,4-0,6 puntos porcentuales en los valores de hemoglobina glucosilada (HbA1c), tanto en monoterapia como en terapia añadida a otros agentes antidiabéticos (sulfonilureas, metformina, pioglitazona e insulina). No se han encontrado diferencias significativas con comparadores activos (glipizida, pioglitazona).
|
Tabla 2. Estudios clínicos de fase 3 con alogliptina controlados |
||
|
Indicación estudiada |
Adición a metformina |
Adición a metformina |
|
Tratamientos comparados (dosis diarias) |
Alogliptina 12,5 mg Alogliptina 25 mg Glipizida 5-20 mg |
Alogliptina 25 mg + Pioglitazona 30 mg Pioglitazona 45 mg |
|
Dosis metformina (media; mg/24 h) |
1828 mg |
1858 mg |
|
Pacientes aleatorizados |
2638 |
803 |
|
Duración estudio |
104 semanas |
52 semanas |
|
Tipo de estudio |
Doble ciego |
Doble ciego |
|
Edad (media) |
55 años (18% ≥65 años) |
55 años (18% ≥65 años) |
|
Sexo (% varones) |
50% |
52% |
|
Duración DM2 (media) |
5,5 años |
7,2 años |
|
HbA1C (media; %) |
7,6% |
8,2% |
|
IMC (media; kg/m2) |
31,2 |
31,6 |
|
Determinación de la variable primaria |
52 semanas |
52 semanas |
|
Variación HbA1C (%), en puntos porcentuales |
Alogliptina* (12.5): -0,62 Alogliptina* (25): -0,61 Glipizida: -0,52 |
Alogliptina* (12.5) Pioglitazona (45): -0,29 |
|
Variación glucemia ayunas (mg/dl) |
Alogliptina (12,5): -0,28 Alogliptina (25): -0,40 Glipizida: +0,05 |
Alogliptina (12.5) Pioglitazona (45): -0,21 |
|
Variación peso (kg) |
Alogliptina (12,5): -0,64 Alogliptina (25): -0,91 Glipizida:+0,89 |
Alogliptina (12.5) Pioglitazona (45): +1,60 |
|
Referencia |
EMA, 2013 |
Bosi, 2011 |
Notas. Todas las diferencias entre los datos correspondientes a la alogliptina y los del comparador fueron estadísticamente significativas, salvo aquellas notadas con un asterisco (*).
Desde el punto de vista de la seguridad, la alogliptina presenta un perfil toxicológico equiparable al de otros agentes inhibidores de la DPP-4, con frecuentes eventos adversos aunque generalmente leves o moderados, transitorios y tratables fácilmente. La incidencia de eventos adversos que condujeron a la descontinuación del tratamiento fue del 3,6% (alogliptina 12,5 mg), 4,1% (alogliptina 25 mg), 5,8% (comparadores activos) y 2,3% con placebo; por su parte, la incidencia de eventos adversos graves relacionados con el tratamiento fue del 4,0%, 4,7%, 5,2% y 3,2%, respetivamente. Conviene recordar que los inhibidores de la DPP-4 incrementan ligeramente (en torno al 19%) el riesgo de padecer una insuficiencia cardiaca aguda, aunque no parece que la alogliptina se diferencie del resto de los fármacos del grupo. Tampoco debe olvidarse que, aunque la frecuencia de cuadros de pancreatitis asociados al tratamiento con alogliptina es bajo, parece ser mayor que el de los comparadores activos.
Según el Informe de Posicionamiento Terapéutico (AEMPS, 2015), la alogliptina es una opción más a considerar dentro del grupo de los inhibidores DPP-4, sin que aporte ventajas claras que lo diferencien de los restantes miembros del grupo. En este sentido, puede considerarse una opción terapéutica en combinación con metformina, en aquellos pacientes en los que dieta, ejercicio y metformina no sean suficientes para conseguir un control glucémico, como alternativa a añadir sulfonilureas cuando exista contraindicación o intolerancia al uso de sulfonilureas; también puede considerarse en combinación doble con insulina, como alternativa a metformina y/o sulfonilureas, en intolerancia o contraindicación para su uso; en combinación doble con pioglitazona, en pacientes con control prandial aceptable y glucemias basales elevadas, en caso de intolerancia o contraindicación a metformina y sulfonilureas; en combinación con metformina más pioglitazona, como alternativa a añadir sulfonilureas cuando estas no se consideren adecuadas; finalmente, también puede considerarse en combinación con metformina más insulina, como alternativa a añadir sulfonilureas.
Para determinar el valor de la alogliptina en relación a los restantes miembros de su grupo farmacológico, resulta interesante la realización de un reciente metanálisis (Esposito, 2015) de 98 ensayos clínicos de los cinco inhibidores de la DPP-4 actualmente comercializados (incluyendo a la alogliptina), controlados con placebo o comparadores activos y de al menos 12 semanas de duración. Esta metanálisis ha permitido confeccionar un nomograma capaz de predecir el efecto cuantitativo de cada uno de estos fármacos, en función de los valores basales de la tasa de hemoglobina (Hb1Ac) y de la glucemia en ayunas, en términos de reducción de puntos porcentuales HbA1c. La aplicación de este nomograma para un paciente con valores basales de 8,0% de hemoglobina glucosilada y glucemia en ayunas de 150 mg/dl, indica que la reducción de la tasa de HbA1c sería de 0,95 puntos con alogliptina, 1,05 con vildagliptina, 0,92 con sitagliptina, 0,84 con saxagliptina y 0,67 con linagliptina; si la glucemia basal fuera de 190 mg/dl (y la hemoglobina glucosilada del 8,0%), los correspondientes descensos esperables de la HbA1c serían de 0,55 (alogliptina), 0,65 con vildagliptina, 0,50 con sitagliptina, 0,43 con saxagliptina y 0,27 con linagliptina.
En resumen, un nuevo miembro del grupo de inhibidores de la DPP-4, aparentemente sin ningún aspecto innovador reseñable.
|
VALORACIÓN |
|
|
ALOGLIPTINA |
|
|
Grupo Terapéutico (ATC): A10BH. TRACTO ALIMENTARIO Y METABOLISMO. Antidiabéticos: inhibidores de la dipeptidil peptidasa 4 (DPP-4). |
|
|
Indicaciones autorizadas: Tratamiento de adultos con diabetes mellitus tipo 2 a partir de los 18 años de edad, para mejorar el control glucémico en combinación con otros medicamentos hipoglucemiantes, incluida la insulina, cuando estos, junto con dieta y ejercicio, no proporcionan un control glucémico adecuado. |
|
|
VALORACIÓN GLOBAL: SIN INNOVACIÓN. No implica aparentemente ninguna mejora farmacológica ni clínica en el tratamiento de las indicaciones autorizadas. |
♣ |
|
FÁRMACOS RELACIONADOS REGISTRADOS EN ESPAÑA |
|||
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Sitagliptina |
Januvia |
Mersck Sharp Dohme |
2007 |
|
Vildagliptina |
Galvus |
Novartis |
2008 |
|
Saxagliptina |
Onglyza |
Bristol Myers Squibb |
2010 |
|
Linagliptina |
Trajenta |
Boehringer Ingelheim |
2012 |
|
Alogliptina |
Vipidia |
Takeda |
2015 |
BIBLIOGRAFÍA
Bibliografía
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de Posicionamiento Terapéutico de la alogliptina (Vpidia®). 3 de agosto de 2015. http://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-alogliptina-vipidia.pdf
- Bosi E, Ellis GC, Wilson CA, Fleck PR. Alogliptin as a third oral antidiabetic drug in patients with type 2 diabetes and inadequate glycaemic control on metformin and pioglitazone: a 52-week, randomized, double-blind, active-controlled, parallel-group study. Diabetes Obes Metab. 2011; 13(12): 1088-96. doi: 10.1111/j.1463-1326.2011.01463.x.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S. Linagliptina (Trajenta®) en diabetes mellitus de tipo 2. Panorama Actual Med 2012; 36(350): 54-60.
- DeFronzo RA, Fleck PR, Wilson CA, Mekki Q; Alogliptin Study 010 Group. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor alogliptin in patients with type 2 diabetes and inadequate glycemic control: a randomized, double-blind, placebo-controlled study. Diabetes Care. 2008; 31(12): 2315-7. doi: 10.2337/dc08-1035.
- Escalada San Martín FJ. Tratamiento de la diabetes mellitus. En: Terapéutica farmacológica de los trastornos del aparato digestivo, metabolismo y sistema endocrino. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2013. p. 341-60.
- Esposito K, Chiodini P, Maiorino MI, Capuano A, Cozzolino D, et al. A nomogram to estimate the HbA1c response to different DPP-4 inhibitors in type 2 diabetes: a systematic review and meta-analysis of 98 trials with 24 163 patients. BMJ Open. 2015; 5(2): e005892. doi: 10.1136/bmjopen-2014-005892.
- European Medicines Agency (EMA). Vipidia®. European Public Assessment Report (EPAR). EMA/474704/2013; EMEA/H/C/002182. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002182/WC500152273.pdf
- Federación de Diabéticos Españoles. http://www.fedesp.es/portal/quienes_dir/quienes_somos.aspx (11 de mayo de 2015)
- Garber AJ. Novel GLP-1 receptor agonists for diabetes. Expert Opin Investig Drugs. 2012; 21(1): 45-57. doi: 10.1517/13543784.2012.638282.
- Menéndez Torre E, Lafita Tejedor J, Artola Menéndez S, et al. Recomendaciones para el tratamiento farmacológico de la hiperglucemia en la diabetes tipo 2. Av Diabetol. 2010; 26: 331-8.
- Monami M, Dicembrini I, Mannucci E. Dipeptidyl peptidase-4 inhibitors and heart failure: a meta-analysis of randomized clinical trials. Nutr Metab Cardiovasc Dis. 2014; 24(7): 689-97. doi: 10.1016/j.numecd.2014.01.017.
- Nauck MA, Ellis GC, Fleck PR, Wilson CA, Mekki Q; Alogliptin Study 008 Group. Efficacy and safety of adding the dipeptidyl peptidase-4 inhibitor alogliptin to metformin therapy in patients with type 2 diabetes inadequately controlled with metformin monotherapy: a multicentre, randomised, double-blind, placebo-controlled study. Int J Clin Pract. 2009; 63(1): 46-55. doi: 10.1111/j.1742-1241.2008.01933.x.
- Pratley RE, Reusch JE, Fleck PR, Wilson CA, Mekki Q; Alogliptin Study 009 Group. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor alogliptin added to pioglitazone in patients with type 2 diabetes: a randomized, double-blind, placebo-controlled study. Curr Med Res Opin. 2009; 25(10): 2361-71. doi: 10.1185/03007990903156111.
- Pratley RE), Kipnes MS, Fleck PR, Wilson C, Mekki Q; Alogliptin Study 007 Group. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor alogliptin in patients with type 2 diabetes inadequately controlled by glyburide monotherapy. Diabetes Obes Metab. 2009; 11(2): 167-76. doi: 10.1111/j.1463-1326.2008.01016.x.
- Rosenstock J, Rendell MS, Gross JL, Fleck PR, Wilson CA, Mekki Q. Alogliptin added to insulin therapy in patients with type 2 diabetes reduces HbA1c without causing weight gain or increased hypoglycaemia. Diabetes, Obesity and Metabolism, 2009; 11: 1145–1152.
- Soriguer F, Goday A, Bosch-Comas A, Bordiú E, Calle-Pascual A, Carmena R, et al. Prevalence of diabetes mellitus and impaired glucose regulation in Spain: the Di@bet.es Study. Diabetologia. 2012; 55: 88-93.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares





