Alirocumab (▼Praluent®, Sanofi Aventis) en hipercolesterolemia primaria y dislipemia mixta
 Nº393
Nº393
Resumen
El alirocumab es un anticuerpo monoclonal con propiedades hipolipemiantes, que actúa uniéndose a la proteína PCSK9, provocando una reducción de la degradación intracelular de los receptores de LDL-colesterol y, en consecuencia, una reducción de los niveles de LDL-colesterol (cLDL) en sangre. Ha sido autorizado para el trata de pacientes adultos con hipercolesterolemia primaria (familiar heterocigótica y no familiar) o dislipidemia mixta, como tratamiento complementario a la dieta en combinación con una estatina o una estatina con otros tratamientos hipolipemiantes en pacientes que no consiguen alcanzar sus objetivos de cLDL con la dosis máxima tolerada de una estatina; también está indicado en monoterapia o en combinación con otros tratamientos hipolipemiantes en pacientes con intolerancia a las estatinas, o en los que se contraindique el uso de una estatina. Está estrechamente relacionado biológica y farmacológicamente con evolocumab, pero sin aportar ningún aspecto innovador con respecto a éste. Su uso está restringido fundamentalmente como tratamiento de segunda línea para pacientes con hipercolesterolemia primaria familiar o no que no esté adecuadamente controlada con dosis máximas de estatinas – o que no las toleren o estén contraindicadas – o con otros agentes hipolipemiantes de primera elección.
ASPECTOS FISIOPATOLÓGICOS
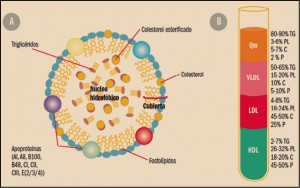
Los lípidos son sustancias que nuestro organismo utiliza como almacén de energía y que desempeñan importantes funciones (formación de las membranas celulares, modificación de proteínas, producción de hormonas, etc.). Por su carácter liposoluble, estas moléculas precisan, para su transporte en el medio acuoso que constituye el plasma, de un vehículo adecuado. Colesterol, triglicéridos y fosfolípidos se transportan en el plasma formando macrocomplejos en los que las moléculas más hidrófobas se disponen en el centro y se recubren de otras hidrófilas, como fosfolípidos y apolipoproteína. Estos macrocomplejos son lo que conocemos como lipoproteínas (Figura 1), entre las que se diferencian varios tipos (de baja densidad –LDL–, de alta densidad –HDL–, etc.) en función de la composición del núcleo lipófilo y el tipo de apoproteínas que presentan (algunas de las cuales constituyen la tarjeta de presentación de las lipoproteínas a su receptor). Los niveles plasmáticos de lipoproteínas reflejaran por tanto los de los lípidos que contienen (Cuéllar, 2016).
Las dislipemias son alteraciones del metabolismo lipídico que conducen a desviaciones de los valores normales de las lipoproteínas o los lípidos en el organismo. Se denominan primarias cuando se deben a una alteración genética o a una dieta inadecuada, y secundarias cuando están relacionadas con patologías que alteran el metabolismo lipídico, como son la diabetes mellitus, trastornos renales, hipotiroidismo o la administración de algunos medicamentos (p. ej., los inhibidores de la proteasa, la ciclosporina o las tiazidas).
El incremento de los niveles de colesterol unido a LDL (cLDL) y la disminución de los de colesterol unido a HDL (cHDL) constituyen, junto con la hipertensión y el tabaquismo, los principales factores de riesgo modificables para la aterosclerosis, una enfermedad sistémica que afecta a las arterias alterándolas progresivamente y formando placas esclerosadas que llegan a reducir la luz vascular (estenosis), conduciendo a situaciones con mayor o menor grado de isquemia del área afectada, y cuya rotura puede desencadenar la activación plaquetaria, dando lugar a trombosis o embolia, que pueden causar un infarto o un accidente cerebrovascular.
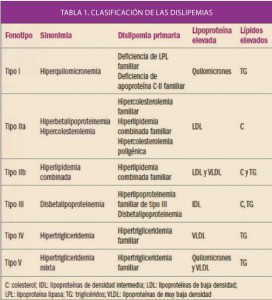
Las dislipemias han sido objeto de distintos sistemas de clasificación. La de Fredrickson (Tabla 1) es la más útil en cuanto a terapéutica, pero debemos saber que en cada uno de los tipos se pueden encontrar distintas enfermedades (primarias o secundarias a otras patologías) que pueden dar lugar a la alteración de los niveles de un tipo de lipoproteína. La reducción del cLDL y los triglicéridos retrasa la progresión e incluso puede reducir la placa de ateroma. Todos los datos disponibles indican que el control de las dislipemias es esencial en la prevención primaria y secundaria de las enfermedades cardiovasculares.
La hiperlipidemia familiar es un trastorno genético en el que se agrupan varias patologías. La más común es la hipercolesterolemia familiar, caracterizada por la presencia de elevadas concentraciones sanguíneas de cLDL y por el desarrollo prematuro de enfermedades cardiovasculares. Está asociada a la existencia de mutaciones del gen codificador del receptor de LDL (R-LDL) en el 95% de los casos, aunque también se asocia con mutaciones de los genes codificadores de Apolipoproteína B (ApoB) y de la PCSK9 (Proprotein convertase subtilisin/kexin type 9), un enzima codificado que se une al R-LDL presente en los hepatocitos, facilitando su internalización y degradación.
En su forma heterocigótica, la hipercolesterolemia familiar tiene una prevalencia en la Unión Europea de 1:200 a 1:500 y, a pesar de tratamiento hipolipemiante intensivo, presenta una tasa de mortalidad doble de lo normal. Por su parte, la forma homocigótica es aún mucho más grave, cursando con niveles de cLDL y colesterol total extraordinariamente elevados, lo que determina una alta mortalidad incluso en edad infantil y juvenil; afortunadamente, es mucho más infrecuente que la forma heterocigótica, con una prevalencia entre 1:300.000 y 1:1.000.000.
En el caso de las dislipemias secundarias, el primer paso debe ser el tratamiento de la patología de base y, en todos los casos, controlar la dieta y favorecer un estilo de vida saludable –ejercicio, abandonar el tabaco, moderar el consumo de alcohol– y, si fuese necesario, administrar tratamiento farmacológico.
Los ácidos grasos constituyen la base de los lípidos del organismo. Son ácidos orgánicos con cadenas hidrocarbonadas de diferente longitud y grado de saturación. Estos ácidos grasos se esterifican con otras sustancias como glicerol y ácido fosfórico, dando lugar entre otros productos a triglicéridos y fosfolípidos, o bien son metabolizados a esteroles, dando lugar al colesterol. Como ya se ha dicho, al ser inmiscibles en el medio acuoso de la sangre, los lípidos necesitan acoplarse a un vehículo adecuado. Los ácidos grasos no esterificados se asocian a la albumina, pero los restantes constituyen las lipoproteínas. Este sistema permite movilizar los triglicéridos desde el intestino y el hígado hasta los puntos de utilización o almacenamiento (tejido adiposo y musculo) y transportar el colesterol allí donde se necesita, por ejemplo para la síntesis de membranas, la producción de hormonas esteroideas o la síntesis de ácidos biliares.
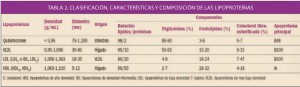
Las lipoproteínas (Tabla 2) se clasifican según su densidad (a mayor densidad, mayor contenido en proteínas, y a mayor diámetro, mayor contenido de lípidos) y, como veremos, cada tipo ejerce distintas funciones:
- Quilomicrones: se forman en el intestino, contienen apoproteína B48 y transportan fundamentalmente los triglicéridos, los fosfolípidos y el colesterol procedentes de la dieta y de la síntesis en el epitelio intestinal. En los tejidos periféricos ricos en lipoproteína lipasa (LPL), liberan ácidos grasos.
- Lipoproteínas de muy baja densidad (VLDL, very low density lipoproteins): contienen apoproteína B (ApoB), C y E y transportan triglicéridos y colesterol, sintetizados en el hígado, hacia los tejidos periféricos, cediendo igualmente ácidos grasos en tejidos periféricos.
- Lipoproteínas de baja densidad (LDL, low density lipoproteins): proceden de las VLDL (presentan por tanto las mismas apoproteínas) y representan el principal sistema de transporte del colesterol hacia las células de los tejidos periféricos.
- Lipoproteínas de alta densidad (HDL, high density lipoproteins): contienen fundamentalmente apoproteína A (ApoA), C y E. Transportan el colesterol cedido por las células de los tejidos periféricos al hígado. Es, por tanto, un mecanismo bioquímico hipocolesterolemiante.
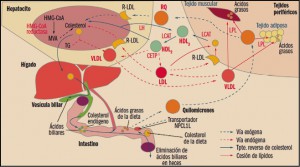
Los enterocitos liberan los lípidos absorbidos a la linfa en forma de quilomicrones ricos en triglicéridos. En los capilares del tejido adiposo y muscular esquelético, ricos en lipoproteína lipasa (LPL), los lípidos contenidos en los quilomicrones son hidrolizados a ácidos grasos, que son asimilados por las células de estos tejidos, donde se almacenan, constituyendo un depósito de energía, o se emplean como materia prima para la síntesis de otros lípidos (Figura 2). Los quilomicrones remanentes, que no han perdido su colesterol, sufren un proceso de endocitosis en el hígado.
El colesterol hepático, ya sea de origen endógeno o exógeno, puede ser esterificado y almacenado, excretarse en la bilis como colesterol libre o ser transformado en ácidos biliares, constituir nuevas lipoproteínas o incorporarse a las membranas plasmáticas de los hepatocitos. Aproximadamente el 80% del colesterol endógeno procede de síntesis hepática y se libera a la circulación en forma de VLDL; a nivel de los capilares del musculo esquelético y del tejido graso, las VLDL sufren el ataque de la LPL, que hidroliza los triglicéridos y libera ácidos grasos, que son captados por los tejidos y convierten a las VLDL en LDL. Los niveles elevados de LDL y su oxidación forman parte de la base etiopatogénica de la aterosclerosis. Las LDL circulantes son reconocidas por receptores presentes en las membranas celulares (R-LDL), produciéndose su endocitosis al interior celular. Allí se convierten en sustrato de enzimas lisosomales, cediendo colesterol libre.
Las HDL se sintetizan en el hígado y en el intestino, pero también en la sangre circulante a partir de apoproteínas y fosfolípidos procedentes de la hidrolisis de los quilomicrones y las VLDL por la LPL. Las HDL son responsables del denominado transporte inverso de colesterol, es decir, del que se produce desde las células periféricas al hígado. Esta es la razón por la que los niveles altos de cHDL se asocian a un menor riesgo de cardiopatía isquémica. Estas HDL nacientes captan el colesterol libre de la superficie de las membranas celulares en tejidos periféricos y, por acción de la lecitincolesterol-acil transferasa (LCAT), van aumentando su contenido en colesterol esterificado y su tamaño, convirtiéndose en partículas de HDL2 que pueden acceder al hepatocito para ceder el colesterol, o bien convertirse en HDL3 por acción de la lipasa hepática, que libera triglicéridos. El colesterol esterificado no atraviesa las membranas celulares y se intercambia, gracias a la proteína de transferencia de esteres de colesterol (CETP), por los triglicéridos de las VLDL y LDL.
Según la Organización Mundial de la Salud (OMS), las enfermedades cardiovasculares se encuentran entre las 10 primeras causas de muerte en todos los países del mundo, y en el caso concreto de la aterosclerosis, resulta la primera causa de muerte e incapacidad en los países desarrollados. En la actualidad, se considera un proceso inmunoinflamatorio crónico de origen multigénico y multifactorial, que comienza tempranamente por una disfunción del endotelio vascular y modificaciones oxidativas de los lípidos sanguíneos atrapados en el subendotelio vascular. Los lípidos depositados en las lesiones ateroscleróticas provienen fundamentalmente de las LDL circulantes, que ingresan en la pared vascular a través de este endotelio lesionado o disfuncional.
La enfermedad se desarrolla de forma intermitente en el tiempo; se observa que el crecimiento de las placas es discontinuo, se intercalan periodos de inactividad con otros de rápida evolución y todo ello es modulado por factores ambientales y genéticos. El resultado final es que, como consecuencia de una serie de factores etiopatogénicos, tiene lugar la aparición y desarrollo de lesiones con mayor o menor contenido lipídico, presencia de colágeno, fibras elásticas y calcio, que, en casos avanzados, pueden sufrir complicaciones (rotura o fisura de la placa, con el evidente riesgo de trombosis). La localización y el grado de desarrollo de estas lesiones dan lugar a las diferentes formas de enfermedad aterosclerótica, que se caracterizaran por unos síntomas y signos que corresponden, bien a la obliteración de la luz vascular con disminución del flujo y aparición de isquemia crónica, bien a la obstrucción de dicha luz por rotura de la placa y aparición de fenómenos trombóticos (debido a que el núcleo lipídico de la placa es altamente trombogénico y desencadena la activación de las cascadas de la coagulación y de la adhesión y agregación plaquetarias), con manifestaciones de isquemia aguda.
La prevención y tratamiento de las dislipemias deben contemplarse como parte fundamental de la prevención de la enfermedad cardiovascular. Como tal, sus objetivos deben ajustarse atendiendo al riesgo cardiovascular que presenta el paciente concreto. A lo largo de numerosos y amplios ensayos clínicos, se ha evidenciado que la reducción de los niveles séricos de colesterol total y de cLDL comporta una reducción del riesgo cardiovascular, por lo que esto se convierte en objetivo prioritario del tratamiento, al que pueden seguir los valores de otras fracciones lipídicas asociadas a la aterosclerosis.
Existe abundante documentación clínica que demuestra que los niveles plasmáticos altos de colesterol se relacionan con un aumento de la incidencia de la morbilidad y mortalidad cardiovasculares. La aparentemente obvia conclusión de que el tratamiento hipolipemiante estaría justificado en todos los casos de pacientes con riesgo cardiovascular, sin embargo, es todavía objeto de polémica y está lejos de haberse demostrado esta máxima terapéutica para todos los agentes hipolipemiantes. En general, con cifras de disminución del LDL-colesterol del orden del 25-30% hay un retardo significativo en la progresión de la arteriosclerosis en arteria coronaria y carotidea (la regresión de las lesiones se produce pocas veces). Los objetivos terapéuticos están recogidos en la tabla 3.
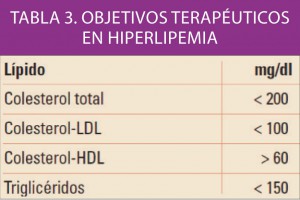
Por tanto, el criterio principal subrogado1 para juzgar la eficacia del tratamiento es el descenso de la fracción LDL y el aumento de la fracción HDL. Actualmente, hay una tendencia a evitar los tratamientos farmacológicos hipocolesterolemiantes en pacientes jóvenes sin factores de riesgo cardiovascular, e intensificarlos en cambio en pacientes que hayan sufrido un episodio coronario o presenten, en general, un nivel de riesgo coronario y/o cerebrovascular de moderado a elevado. Algunas normas fijan objetivos del tratamiento en términos de niveles de LDL y en función de la presencia o no de enfermedad coronaria y de la existencia de factores adicionales de riesgo. En cualquier caso, la terapia hipolipemiante parece evolucionar a tratamientos cada vez más selectivos, pero también más intensivos.
Los denominados inhibidores de la HMG-CoA reductasa, más comúnmente referidos como estatinas (atendiendo al sufijo común de esos fármacos), actúan inhibiendo competitivamente uno de los enzimas claves en el proceso de síntesis del colesterol en el organismo. Producen una reducción rápida e intensa de colesterol total (15-30%) y de cLDL (25-60%), un descenso moderado de triglicéridos (10-25%) y ligero ascenso (4-10%) de cHDL. La experiencia es de buena tolerancia aunque ocasionalmente producen aumento de las transaminasas séricas (que revierten al suspender el tratamiento) o miositis.
La inhibición de la HMG-CoA reductasa produce una activación de las proteínas reguladoras SREBP (sterol regulatory elements-binding proteins), que activan la transcripción de proteínas e incrementan la expresión del gen del receptor de LDL y un aumento en la cantidad de receptores funcionales en el hepatocito, dando lugar a una mayor eliminación de las LDL circulantes, lo que disminuye las concentraciones de cLD. El orden de potencia hipolipemiante de las estatinas a nivel equimolecular es: pitavastatina > rosuvastatina > atorvastatina > simvastatina > pravastatina = lovastatina > fluvastatina. Sin embargo, cuando se utilizan dosis equivalentes, el efecto terapéutico es similar. Al doblar la dosis de cualquier estatina, el aumento relativo en la reducción de cLDL es, en general, del 6-7%. El efecto sobre los triglicéridos es mayor en los sujetos con triglicéridos >250 mg/dl, en los que se alcanza el 35% de reducción. Las estatinas actúan rápidamente, inhibiendo la enzima limitante en pocas horas; asimismo, más del 90% del efecto reductor de cLDL se consigue las primeras cuatro semanas de tratamiento, sin que sea haya evidenciado tolerancia farmacológica con el tratamiento crónico.
Aparte de sus efectos sobre el perfil lipídico, las estatinas tienen otros efectos cardiovasculares beneficiosos, especialmente sobre la pared arteria y que explicarían el beneficio adicional no atribuible a la reducción del cLDL observado en muchos estudios de intervención (efectos pleiotrópicos). Al inhibir la HMG-CoA reductasa, las estatinas interfieren en la formación de isoprenoides a partir del mevalonato. Como consecuencia de esto, la prenilación de las proteínas G (Rho, Rac, Rab y Ras) se reduce. La prenilación de estas moléculas es necesaria para su anclaje a la membrana celular y, así, poder ejercer su mecanismo de acción relacionado con la migración, la diferenciación y la proliferación celular. A través de estos potenciales efectos sobre las proteínas celulares, las estatinas pueden tener una serie de propiedades antiateroscleróticas y antitrombóticas, como la inhibición del crecimiento de la célula muscular lisa, la adhesión celular, la activación plaquetaria y la secreción de proteína C reactiva, entre otras. Por todo ello, actualmente se considera a las estatinas como tratamiento hipolipemiante de referencia (Cuéllar, 2011).
Los derivados del ácido clofíbrico reducen fundamentalmente los niveles de triglicéridos (30-50%), y consecuentemente cVLDL, y aumentan los de cHDL (10-20%). La acción reductora sobre colesterol total (10-20%) y cLDL (5-10%) es comparativamente mucho menor, y muy variable según el fármaco. Los medicamentos más modernos, únicos que permanecen en el mercado, como el fenofibrato y bezafibrato, etc., son más activos que el clofibrato sobre el colesterol y fracciones lipídicas relacionadas. Por su parte, gemfibrozilo tiene poco efecto sobre el colesterol, pero en cambio tiene una acción más pronunciada sobre triglicéridos y en ciertos casos produce una elevación significativa de la fracción cHDL.
Entre los adsorbentes o secuestrantes de sales biliares, colestipol, colesevelam y colestiramina son polímeros de intercambio aniónico, mientras que el detaxtrano es un derivado del dextrano mucho menos difundido y documentado. Se encuentran entre los medicamentos hipolipemiantes más antiguos, aunque no por ello su eficacia es cuestionada. De hecho, forman parte de todas las estrategias terapéuticas hipocolesterolemiantes, tanto solos como en asociación con estatinas. Reducen los niveles de cLDL en un 10-30% y en combinación con ácido nicotínico o con estatinas dicha reducción puede alcanzar el 60%. Actúan uniéndose a los ácidos biliares presentes en el intestinal, formando complejos inabsorbibles que son eliminados con las heces y, por tanto, impiden la reabsorción de dichos ácidos biliares. A medida que la reserva orgánica de estos se agota, el enzima colesterol 7α hidrolasa experimenta una regulación al alza, incrementado la tasa de conversión de colesterol en ácidos biliares, lo que a su vez provoca un aumento de la demanda de colesterol por parte de los hepatocitos, dando lugar a un incremento tanto de la expresión como de la actividad de la HMG-Coa reductasa, así como del número de receptores hepáticos de LDL. Estos efectos compensatorios potencian la eliminación de cLDL de la sangre y, por consiguiente, reducen sus niveles.
A pesar de su eficacia probada y de que no son absorbidos en el tracto intestinal, se asocian con una elevada tasa de discontinuidad en el tratamiento, debido fundamentalmente a las molestias gastrointestinales, en especial el estreñimiento que llega a afectar al 40% de los pacientes tratados. Además, producen flatulencia, borborigmos y calambres intestinales.
El interés por los aceites poliinsaturados de pescado surgió de estudios epidemiológicos indicativos de que poblaciones con dietas ricas en pescado (esquimales, japoneses) tienen una incidencia de enfermedades cardiovasculares significativamente inferior a otros grupos de población con consumo equivalente de grasas animales o vegetales. Los preparados de aceite de pescado son mezclas de los ácidos eicosapentaenoico y docosaexaenoico, en la que la acción farmacológica principal la ejerce el primero. El segundo actúa fundamentalmente de reserva transformándose lentamente en ácido eicosapentaenoico, aunque puede tener funciones biológicas aún no bien conocidas. Aunque a dosis terapéuticas ambos se comportan como hipolipemiantes, desarrollan significativos otros efectos preventivos cardiovasculares cuya naturaleza es compleja, porque modifican la proporción de los diversos tipos de prostaglandinas del organismo, lo que puede traducirse en acción vasodilatadora e inhibición de la agregación plaquetaria.
La ezetimiba es un agente hipolipemiante que reduce la absorción intestinal del colesterol procedente de la dieta y de la secreción biliar. En dosis terapéuticas, es capaz de reducirla en más de un 50%. En términos generales, la ezetimiba reduce los niveles de cLDL en un 17-20% en monoterapia, y en más del 40% en combinación con estatinas. Tiene una acción reductora moderada sobre triglicéridos (10%) e incrementa modestamente los niveles de HDL (5-10%). Actúa situándose en las microvellosidades del intestino delgado, inhibiendo la captación del colesterol por los enterocitos, a través de un mecanismo aún no bien dilucidado.
La última incorporación en el ámbito del tratamiento de la hipercolesterolemia primaria ha sido el evolocumab, un anticuerpo monoclonal con propiedades hipolipemiantes, que actúa uniéndose a la proteína PCSK9, provocando una reducción de la degradación intracelular de los receptores de LDL-colesterol y, en consecuencia, una reducción de los niveles de LDL-colesterol (cLDL) en sangre.
ACCIÓN Y MECANISMO
El alirocumab es un anticuerpo monoclonal con propiedades hipolipemiantes, que actúa uniéndose a la proteína PCSK9, provocando una reducción de la degradación intracelular de los receptores de LDL-colesterol y, en consecuencia, una reducción de los niveles de LDL-colesterol (cLDL) en sangre. Ha sido autorizado para el trata de pacientes adultos con hipercolesterolemia primaria (familiar heterocigótica y no familiar) o dislipidemia mixta, como tratamiento complementario a la dieta en combinación con una estatina o una estatina con otros tratamientos hipolipemiantes en pacientes que no consiguen alcanzar sus objetivos de cLDL con la dosis máxima tolerada de una estatina; también está indicado en monoterapia o en combinación con otros tratamientos hipolipemiantes en pacientes con intolerancia a las estatinas, o en los que se contraindique el uso de una estatina.
La PCSK9 (Proprotein Convertase Subtilisin/Kexin type 9) es un enzima codificado por el gen del mismo nombre, que se une al receptor de LDL presente en los hepatocitos. Cuando la PCSK9 se une al receptor de LDL (R-LDL) presente en la membrana, este sufre un proceso de internalización, pasando al citoplasma donde es degradado. Al bloquear la PCSK9, el alirocumab favorece la permanencia de dichos receptores en la superficie de los hepatocitos y su actividad para retirar las moléculas de LDL-colesterol circulantes en el torrente sanguíneo. Además de los efectos sobre los niveles de cLDL, el alirocumab facilita también la reducción de los de colesterol total, apolipoproteína B (ApoB), cVLDL, triglicéridos y lipoproteína a (Lp(a)).
ASPECTOS MOLECULARES
El alirocumab es un anticuerpo monoclonal enteramente humano que se une selectivamente y con gran afinidad a la proteína PCSK9, inactivándola biológicamente. Se trata de un heterotetrámero consistente en dos cadenas pesadas del isotipo IgG1 unidas entre sí por dos puentes disulfuro (-S-S-), y cada una de ellas unida covalentemente, también a través de un puente disulfuro, a una cadena ligera kappa (κ) humana. Las cadenas pesadas están formadas por 448 aminoácidos cada una, mientras que las ligeras tienen 220 aminoácidos. Presenta un único punto de N-glucosilación (en el aminoácido Asn298 de cada una de las dos cadenas pesadas). El peso molecular total del alirocumab (no glucosilado) es de 146,0 kDa e incluye un total de 16 puentes disulfuro.
El alirocumab guarda una obvia relación biológica con el evolucumab, aunque este último es estructuralmente de isotipo IgG2, presentando la característica estructura en forma de Y, constituida por dos cadenas peptídicas pesadas (con 441 aminoácidos cada una) y otras dos ligeras (con 215 aminoácidos cada una), interconectadas mediante 18 puentes disulfuro (-S-S-), tanto inter como intracatenarios. Tiene un único punto de N-glucosilación (en el aminoácido Asn291 de cada una de las dos cadenas pesadas). El peso molecular total del evolocumab (no glucosilado) es de 141,8 kDa (Cuéllar,2016).
EFICACIA Y SEGURIDAD CLÍNICAS
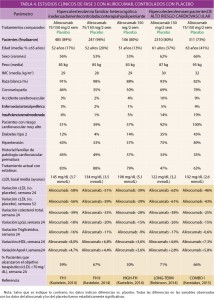
La eficacia y la seguridad clínicas del alirocumab han sido adecuadamente contrastadas en las indicaciones autorizadas mediante diez ensayos clínicos de fase 3 (confirmatorios de eficacia y seguridad), aleatorizados, multicéntricos, doblemente ciegos (abiertos, en algunos casos) y controlados con placebo y comparadores activos (ezetimiba), en pacientes adultos con hiperlipidemia primaria (familiar heterocigótica y no familiar) y dislipemia mixta (pacientes adultos entre 18 y 80 años), tanto en monoterapia tanto en combinación con estatinas y, eventualmente, otros tratamientos hipolipemiantes, en pacientes mayoritariamente de alto riesgo cardiovascular2 que no conseguían alcanzar sus objetivos de cLDL con la dosis máxima tolerada de una estatina o que presentasen intolerancia a las estatinas o en los que esté contraindicado el uso de éstas.
La variable primaria de eficacia utilizada en estos estudios fue la variación porcentual media experimentada en los niveles plasmáticos de cLDL a las 24 semanas desde el inicio del tratamiento. Como variables secundarias de determinaron las variaciones porcentuales y absolutas de ApoB, colesterol total, cHDL, ApoA1, lipoproteína a, triglicéridos, etc., así como determinaciones de seguridad.
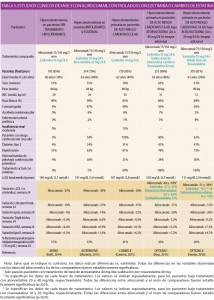
La duración de los estudios osciló entre 24 y 52 semanas. Se utilizaron dosis subcutáneas (SC) de alirocumab de 75 mg cada dos semanas, con un eventual ajuste de la dosis hasta 150 mg a la semana 12ª, según el nivel de cLDL a la 8ª semana (y el nivel de riesgo cardiovascular). Las características y resultados de los ensayos clínicos controlados están recogidos en las tablas 4 (vs. placebo) y 5 (vs. ezetimiba o cambio en la estatina utilizada).
Desde el punto de vista de la seguridad, el alirocumab presenta un perfil toxicológico benigno, con adversos poco frecuentes y generalmente leves o moderados, transitorios y tratables fácilmente. Los eventos adversos más frecuentemente descritos en los ensayos clínicos de fase 3 controlados con placebo fueron: infección gripal (5,7% vs. 4,6% con placebo), infección del tracto respiratorio superior (2,0 vs. 0,9%), dolor abdominal (2,9 vs. 2,4%), mialgia (4,2 vs. 3,4%), espasmos musculares (3,1 vs. 2,4%) y dolor en el punto de la inyección SC (6,7 vs. 4,8%); en los estudios controlados con ezetimiba, los eventos adversos más frecuentes fueron: infección gripal (3,7 vs. 2,3% con ezetimiba), cefalea (3,9 vs. 2,3%), alteraciones coronarias (4,4 vs. 2,8%), atonía gastrointestinal (3,0 vs. 2,4%) y fatiga (2,7 vs. 1,5%).
La incidencia de eventos adversos graves aparecidos durante el tratamiento fue del 13,1-13,7% con alirocumab vs. 14,3% con placebo y 11,2% con ezetimiba. Se procedió a la suspensión del tratamiento en el 5,3-8,8% de los tratados con alirocumab, 5,1% con placebo y 9,7% con ezetimiba.
ASPECTOS INNOVADORES
El alirocumab es un anticuerpo monoclonal con propiedades hipolipemiantes, que actúa uniéndose a la proteína PCSK9, provocando una reducción de la degradación intracelular de los receptores de LDL-colesterol y, en consecuencia, una reducción de los niveles de LDL-colesterol (cLDL) en sangre. Ha sido autorizado para el trata de pacientes adultos con hipercolesterolemia primaria (familiar heterocigótica y no familiar) o dislipidemia mixta, como tratamiento complementario a la dieta en combinación con una estatina o una estatina con otros tratamientos hipolipemiantes en pacientes que no consiguen alcanzar sus objetivos de cLDL con la dosis máxima tolerada de una estatina; también está indicado en monoterapia o en combinación con otros tratamientos hipolipemiantes en pacientes con intolerancia a las estatinas, o en los que se contraindique el uso de una estatina. Está estrechamente relacionado biológica y farmacológicamente con evolocumab.
Los datos clínicos disponibles son abundantes y metodológicamente robustos, con resultados contundentes en relación a la variable clínica principal, el descenso de los niveles séricos de cLDL. En este sentido, la documentación clínica muestra en los pacientes con hipercolesterolemia primaria (familiar heterocigótica y no familiar) o dislipidemia mixta descensos del 39-62% en relación al placebo y del 24-36% vs. ezetimiba al cabo de 24 semanas, tanto en monoterapia como asociación a otros hipolipemiantes (estatinas, ezetimiba, etc.), incluyendo pacientes intolerantes o refractarios al tratamiento con las dosis de máximas de estatinas de alta potencia (atorvastatina y rosuvastatina). Asimismo, otros parámetros lipídicos potencialmente adversos desde el punto de vista del riesgo cardiovascular experimentan descensos notables en los niveles de colesterol total (25-38% vs. placebo y 15-21% vs. ezetimiba), alcanzándose el objetivo terapéutico de <70 mg/dL de cLDL en el 30-71% con relación al placebo y 26-57% a ezetimiba. Se procedió a incrementar la dosis de alirocumab (de 75 a 150 mg cada dos semanas) a las 12 semanas de tratamiento (en función de la respuesta a la 8ª semana) en un 14% de los pacientes que utilizaban estatinas como tratamiento base y en un 3% de los que no.
A pesar de la contundencia de los datos obtenidos en los ensayos clínicos, es preciso recordar que la reducción de los niveles de cLDL es en realidad un marcador subrogado de la disminución del riesgo cardiovascular y que, de momento, no se dispone de ningún dato clínico que demuestre directamente esto último para el alirocumab. No obstante, hay abundante documentación clínica que soporta la solidez de su presunción.
El alirocumab presenta un perfil benigno de seguridad, con incidencia de eventos adversos similares a las encontradas en los estudios controlados con placebo y con ezetimiba, y sin que el incremento de la dosis de 75 a 150 mg supusiese un aumento significativo de la toxicidad. Se ha argumentado que la mayor incidencia de reacciones locales en el punto de inyección, con respecto al placebo, puede deberse a la formación de anticuerpos anti-alirocumab, aunque solo en el 1,2% parece tratarse de anticuerpos neutralizantes. Por otro lado, en los pacientes que experimentaron en algún momento descensos muy marcados en sus niveles de cLDL (<25 mg/dL), se observó un leve incremento de la incidencia de alteraciones metabólicas y oculares.
Es obvia la conveniencia de comparar estos datos con los conocidos para el evolocumab, su antecesor inmediato3 en términos biológicos, farmacológicos y terapéuticos; sin embargo, tan obvia como esta conveniencia es la ausencia actual de estudios clínicos directamente comparativos, por lo que todo lo que puede hacerse es realizar algunas comparaciones de parámetros similares, contando con que el valor comparativo es esencialmente cualitativo, no cuantitativo. En general, las tasas de reducción de los niveles de cLDL documentados con alirocumab son de 40-62% vs. placebo y 24-36% vs. ezetimiba, frente a 60-70% vs. placebo y 40% vs. ezetimiba, con evolocumab.
Más allá de la comparabilidad cuantitativa del efecto sobre los niveles de cLDL, hay algunos otros aspectos relevantes que merecen una mayor atención. La primera es que el evolocumab, pero no el alirocumab, ha demostrado su eficacia en pacientes con hipercolesterolemia primaria homocigótica, incluyendo a jóvenes de 12 a 18 años de edad, lo cual ha sido autorizado como indicación terapéutica. El segundo aspecto diferencial relevante es que el evolocumab – pero no el alirocumab – dispone de datos clínicos (Sabatine, 2015) que asocian directamente su empleo con una reducción significativa del 53% (HR=0,47; IC95 0,28 a 0,78; p=0,003) en la incidencia de eventos cardiovasculares al cabo de un año, en relación con la terapia estándar (0,95 vs. 2,18%). Finalmente, hay estudios clínicos de hasta cinco años de duración con evolocumab (EMA, 2015), frente a solo poco más de un año con alirocumab.
En definitiva, el alirocumab aparece con un buen hipolipemiante, con propiedades biológicas y farmacológicas similares a las del evolocumab, pero sin aportar ningún aspecto innovador con respecto a éste. Su uso está restringido fundamentalmente como tratamiento de segunda línea para pacientes con hipercolesterolemia primaria familiar o no que no esté adecuadamente controlada con dosis máximas de estatinas – o que no las toleren o estén contraindicadas – o con otros agentes hipolipemiantes de primera elección.
|
VALORACIÓN |
|
ALIROCUMAB
|
|
Grupo Terapéutico (ATC): C10AX. SISTEMA CARDIOVASCULAR. Agentes modificadores de lípidos: otros. |
|
Indicaciones autorizadas: Adultos con hipercolesterolemia primaria (familiar heterocigótica y no familiar) o dislipidemia mixta, como tratamiento complementario a la dieta en combinación con una estatina o una estatina con otros tratamientos hipolipemiantes en pacientes que no consiguen alcanzar sus objetivos de C-LDL con la dosis máxima tolerada de una estatina; también está indiado en monoterapia o en combinación con otros tratamientos hipolipemiantes en pacientes con intolerancia a las estatinas, o en los que se contraindique el uso de una estatina. |
|
SIN INNOVACIÓN. No implica aparentemente ninguna mejora farmacológica ni clínica en el tratamiento de las indicaciones autorizadas. |
|
FÁRMACOS RELACIONADOS REGISTRADOS EN ESPAÑA |
|||
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Evolocumab |
Repatha |
Amgen |
2016 |
|
Alirocumab |
Praluent |
Sanofi Aventis |
2016 |
BIBLIOGRAFÍA
Bibliografía
- Bays H, Gaudet D, Weiss R, Ruiz JL, Watts GF, Gouni-Berthold I, et al. Alirocumab as Add-On to Atorvastatin Versus Other Lipid Treatment Strategies: ODYSSEY OPTIONS I Randomized Trial. J Clin Endocrinol Metab. 2015; 100(8): 3140-8. doi: 10.1210/jc.2015-1520.
- Cannon CP, Cariou B, Blom D, McKenney JM, Lorenzato C, Pordy R, et al; ODYSSEY COMBO II Investigators. Efficacy and safety of alirocumab in high cardiovascular risk patients with inadequately controlled hypercholesterolaemia on maximally tolerated doses of statins: the ODYSSEY COMBO II randomized controlled trial. Eur Heart J. 2015; 36(19): 1186-94. doi: 10.1093/eurheartj/ehv028.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S. Evolocumab (Repatha®) en hipercolesterolemia primaria. Panorama Actual Med 2016; 40(390): 53-62.
- European Medicines Agency (EMA). Praluent®. European Public Assessment Report (EPAR). EMA/504805/2015; EMEA/H/C/003882. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/003882/WC500194524.pdf
- European Medicines Agency (EMA). Repatha®. European Public Assessment Report (EPAR). EMA/577183/2015; EMEA/H/C/003766. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/003766/WC500191400.pdf
- Farnier M, Jones P, Severance R, Averna M, Steinhagen-Thiessen E, Colhoun HM, et al. Efficacy and safety of adding alirocumab to rosuvastatin versus adding ezetimibe or doubling the rosuvastatin dose in high cardiovascular-risk patients: The ODYSSEY OPTIONS II randomized trial. Atherosclerosis. 2016; 244: 138-46. doi: 10.1016/j.atherosclerosis.2015.11.010.
- Kastelein JJ, Robinson JG, Farnier M, Krempf M, Langslet G, Lorenzato C, et al. Efficacy and safety of alirocumab in patients with heterozygous familial hypercholesterolemia not adequately controlled with current lipid-lowering therapy: design and rationale of the ODYSSEY FH studies. Cardiovasc Drugs Ther. 2014; 28(3): 281-9. doi: 10.1007/s10557-014-6523-z.
- Kereiakes DJ, Robinson JG, Cannon CP, Lorenzato C, Pordy R, Chaudhari U, Colhoun HM. Efficacy and safety of the proprotein convertase subtilisin/kexin type 9 inhibitor alirocumab among high cardiovascular risk patients on maximally tolerated statin therapy: The ODYSSEY COMBO I study. Am Heart J. 2015; 169(6): 906-915.e13. doi: 10.1016/j.ahj.2015.03.004.
- Moriarty PM, Thompson PD, Cannon CP, Guyton JR, Bergeron J, Zieve FJ; ODYSSEY ALTERNATIVE Investigators. Efficacy and safety of alirocumab vs ezetimibe in statin-intolerant patients, with a statin rechallenge arm: The ODYSSEY ALTERNATIVE randomized trial. J Clin Lipidol. 2015; 9(6): 758-69. doi: 10.1016/j.jacl.2015.08.006.
- Robinson JG, Farnier M, Krempf M, Bergeron J, Luc G, Averna M, et al; ODYSSEY LONG TERM Investigators. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015; 372(16): 1489-99. doi: 10.1056/NEJMoa1501031.
- Roth EM, Taskinen MR, Ginsberg HN, Kastelein JJ, Colhoun HM, Robinson JG. Monotherapy with the PCSK9 inhibitor alirocumab versus ezetimibe in patients with hypercholesterolemia: results of a 24 week, double-blind, randomized Phase 3 trial. Int J Cardiol. 2014; 176(1): 55-61. doi: 10.1016/j.ijcard.2014.06.049.
- Sabatine MS, Giugliano RP, Wiviott SD, Raal FJ, Blom DJ, Robinson J, et al; Open-Label Study of Long-Term Evaluation against LDL Cholesterol (OSLER) Investigators. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015; 372(16): 1500-9. doi: 10.1056/NEJMoa1500858.
1 El concepto de criterio subrogado parte del paralelismo demostrado empíricamente entre un parámetro bioquímico (biomarcador) y unas consecuencias clínicas determinadas. En este caso, los niveles de cLDL y colesterol total (entre otros) son considerados como un indicador subrogado del riesgo cardiovascular en sus diversas manifestaciones patológicas (infarto de miocardio, accidente cerebrovascular, etc.).
2 Pacientes con historial de enfermedad coronaria, accidente cerebrovascular, enfermedad arterial periférica sintomática o insuficiencia renal moderada (tasa de filtración glomerular de entre 30 y 60 ml/min/1,73 m2 durante al menos tres meses).
3 Evolocumab (Repatha®) fue autorizado por la Agencia Europea de Medicamentos el día 17 de julio de 2015, en tanto que alirocumab (Praluent®) lo fue dos meses después: 23 de septiembre de 2015.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares





