Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H): resumen de las actividades de 2022 y 10º aniversario del formulario “notificaram.es”
 Nº465
Nº465
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha publicado de nuevo el resumen de las actividades del Sistema Español de Farmacovigilancia Humana (SEFV-H) durante el año 2022, el tercer año de la pandemia de la COVID-19. Durante este periodo, en España se ha continuado con la vacunación frente al SARS-CoV-2, lo que se ha reflejado en la actividad del SEFV-H:
- En 2022 se recibieron un total de 60 261 notificaciones de sospechas de reacciones adversas a medicamentos.
- En enero de 2023 se cumplieron 10 años de la implementación del formulario electrónico www.notificaRAM.es, disponible para los profesionales sanitarios y la ciudadanía. En este periodo, el 36% de las notificaciones enviadas directamente a los centros autonómicos de farmacovigilancia fueron remitidas a través de este formulario.
- La AEMPS agradece la colaboración de los profesionales sanitarios y la ciudadanía, y recuerda la importancia de notificar cualquier sospecha de reacción adversa o, en el caso de las vacunas, de cualquier acontecimiento adverso. Esta información es muy relevante para identificar potenciales nuevos riesgos de los medicamentos para su posterior análisis.
Como cada año desde 2019, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha comunicado ya el resumen de actividades del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H) correspondiente al año 2022 (AEMPS, 2023a).
En ese año se han registrado en FEDRA (base de datos común para el SEFV-H) un total de 60 261 notificaciones de sospechas de reacciones adversas a medicamentos (RAM) o de acontecimientos adversos tras recibir una vacuna (ESAVI, eventos supuestamente atribuibles a la vacunación o inmunización), lo que ha supuesto un descenso del 26% respecto al año anterior. Del total de 60 261 notificaciones, un 69,4% se notificaron directamente a los centros autonómicos de farmacovigilancia (SEFV-H), un 30,2% a través de la industria farmacéutica y el restante 0,4% fueron casos de sospechas de RAM (ICSR, por sus siglas en inglés) recibidos a partir de la revisión de casos de RAM publicados en las revistas biomédicas, que lleva a cabo la Agencia Europea de Medicamentos (EMA), conocido como el servicio Medical Literature Monitoring, o MLM Service. A este respecto, un caso puede haber sido comunicado por más de una vía.
Con respecto a los casos notificados directamente al SEFV-H, el 67% fueron realizados por profesionales sanitarios y el 33% por la ciudadanía. Del total de los casos notificados al SEFV-H, un 95% fueron notificaciones espontáneas. Para los casos notificados a través de la industria farmacéutica este porcentaje fue de un 57%. El resto de los casos, procedían de sistemas de recogida de información organizada, tales como estudios observacionales, programas de seguimiento de pacientes o acceso al medicamento a través del uso compasivo.
La mayor parte de las notificaciones recibidas por el SEFV-H las realizaron profesionales sanitarios, en concreto, el 39% los profesionales médicos, el 9% los profesionales farmacéuticos y el 6% los profesionales de enfermería. El 33% de las notificaciones las realizaron ciudadanos directamente a través del formulario electrónico, www.NotificaRAM.es.
En cuanto a la gravedad, de los 60 261 casos recibidos, 13 575 (22%) fueron graves (mortal, ingresa o prolonga hospitalización, produce incapacidad, defecto congénito o médicamente relevante). Para los casos notificados al SEFV-H, el porcentaje de casos graves fue del 19%, mientras que para los casos notificados a través de la industria farmacéutica este porcentaje fue del 31%.
La tasa de notificación global en 2022 se ha estimado en 88 casos por cada 100 000 habitantes, o el equivalente de 880 casos por millón de habitantes, tal como se expresan los datos globales del Programa Internacional de Farmacovigilancia de la OMS, conocido como PIDM por sus siglas en inglés, coordinado desde el Uppsala Monitoring Centre (UMC). En el entorno mundial, es una tasa de notificación alta, como se aprecia en la Figura 1. En los datos acumulados de los casos individuales de RAM, conocidos en inglés como ICSR (Individual Case Safety Reports), recibidos entre enero de 2017 y junio de 2022 en la base de datos VigiBase, se puede constatar que la tasa de 880 ICSR por millón de habitantes corresponde al primer grupo de países que aportan anualmente más de 500 casos por millón de habitantes, del conjunto de 172 países miembros del PIDM (UMC, 2022).
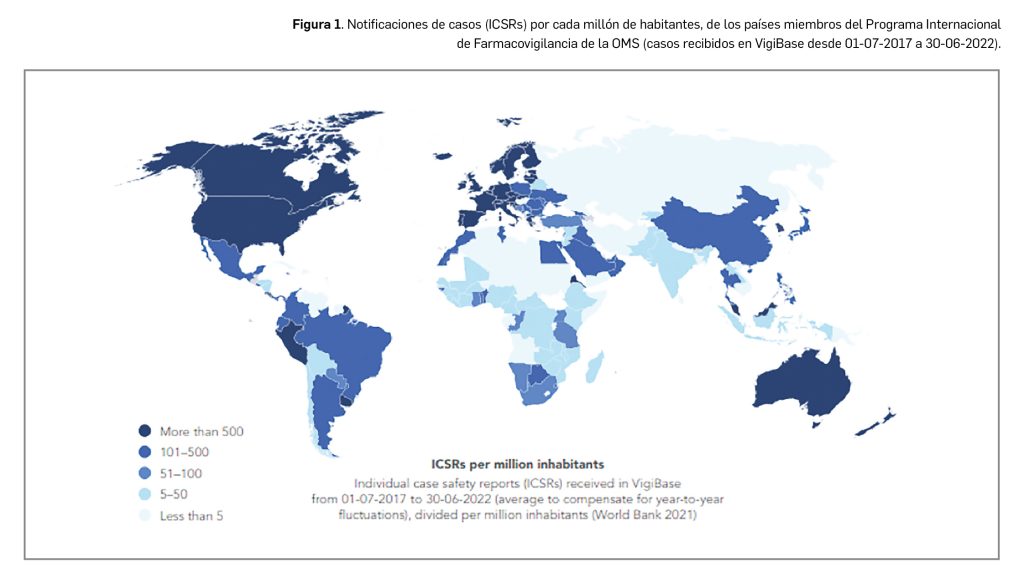
Pero no se debe olvidar que la calidad, y no tanto la cantidad, es la fuente principal de datos de seguridad de medicamentos, importante en farmacovigilancia.
En cuanto a la naturaleza de las sospechas de reacciones adversas notificadas durante el 2022, los trastornos generales, del sistema nervioso y del sistema musculo-esquelético fueron los más frecuentes, al igual que en años anteriores.
10º Aniversario de www.notificaram.es (2013-2023)
Desde enero de 2013, la AEMPS puso a disposición de los profesionales sanitarios y de la ciudadanía un formulario electrónico, equivalente a la llamada tarjeta amarilla, que se había utilizado desde los años 80 en formato papel, para poder notificar las sospechas de reacciones adversas a medicamentos (RAM). Este formulario electrónico, disponible en www.notificaRAM.es, que se cita en las fichas técnicas y los prospectos de los medicamentos, tiene versiones distintas según el notificador sea un profesional sanitario o un/a ciudadano/a y está disponible en las lenguas cooficiales (gallego, vasco-euskara, catalán, valenciano y castellano). Dispone de textos de ayuda y permite notificar errores de medicación con daño, garantizando el anonimato del notificador.
En el pasado enero de 2023 se han cumplido 10 años de esta herramienta para la notificación espontánea de sospechas de RAM. Durante este decenio, de las casi 350 000 notificaciones registradas en FEDRA, 211 875 (61%) se notificaron directamente a los centros autonómicos de farmacovigilancia (SEFV-H). De ellas, 76 295 (36%) fueron remitidas a través del formulario www.notificaRAM.es (Figura 2). El 65% de los casos se concentra en los dos últimos años, resultado de la campaña de vacunación masiva frente a la COVID-19 durante los años 2021 y 2022. Con respecto al tipo de notificador que ha utilizado www.notificaRAM.es, el 59% fueron profesionales sanitarios, mayoritariamente profesionales médicos y farmacéuticos, y el 41% ciudadanos. En el caso de las notificaciones de profesional sanitario se observa que el porcentaje de casos graves aumenta (57%) mientras que cuando se trata de notificaciones de la ciudadanía disminuye (22%). Sin embargo, la notificación de sospechas de RAM graves y desconocidas no varía de manera sustancial dependiendo del notificador (14% para las notificaciones de profesionales sanitarios y 13% de las de ciudadanos/as).
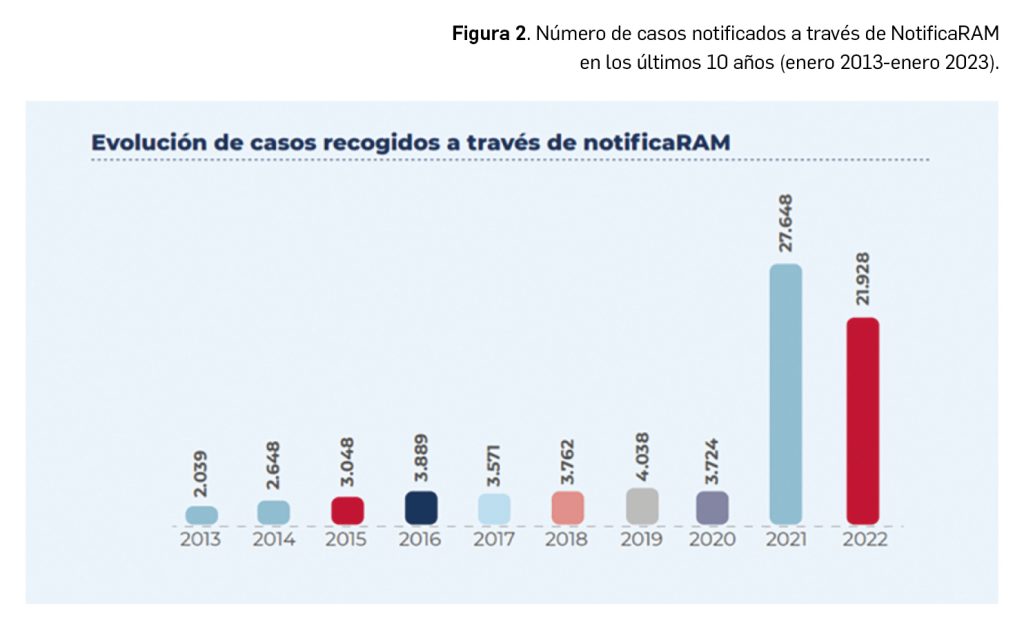
Del total 76 295 notificaciones remitidas a través del formulario www.notificaRAM.es, el 43% de los casos recibidos a través de esta vía cumplían al menos un criterio de gravedad. Las notificaciones graves y desconocidas, es decir, no descritas en la ficha técnica ni el prospecto del medicamento, fueron un 13%. En cuanto al sexo, son más frecuentes las notificaciones que involucran al sexo femenino (66%) en la manifestación de RAM. Sin embargo, para las notificaciones enviadas por los profesionales sanitarios este porcentaje es ligeramente inferior, el 62%, mientras que para las notificaciones enviadas por ciudadanos/as aumenta hasta el 73%.
En cuanto al tipo de notificador en estos 10 años, en la Figura 3 se describe cómo el 59% fueron profesionales sanitarios, mayoritariamente profesionales médicos y farmacéuticos, y el 41% ciudadanos. En el caso de las notificaciones de profesional sanitario se observa como el porcentaje de casos graves aumenta (57%) mientras que cuando se trata de notificaciones de la ciudadanía disminuye (22%). Sin embargo, la notificación de sospechas de RAM graves y desconocidas no varía de manera sustancial dependiendo del notificador (14% para profesionales sanitarios y 13% ciudadanos/as).
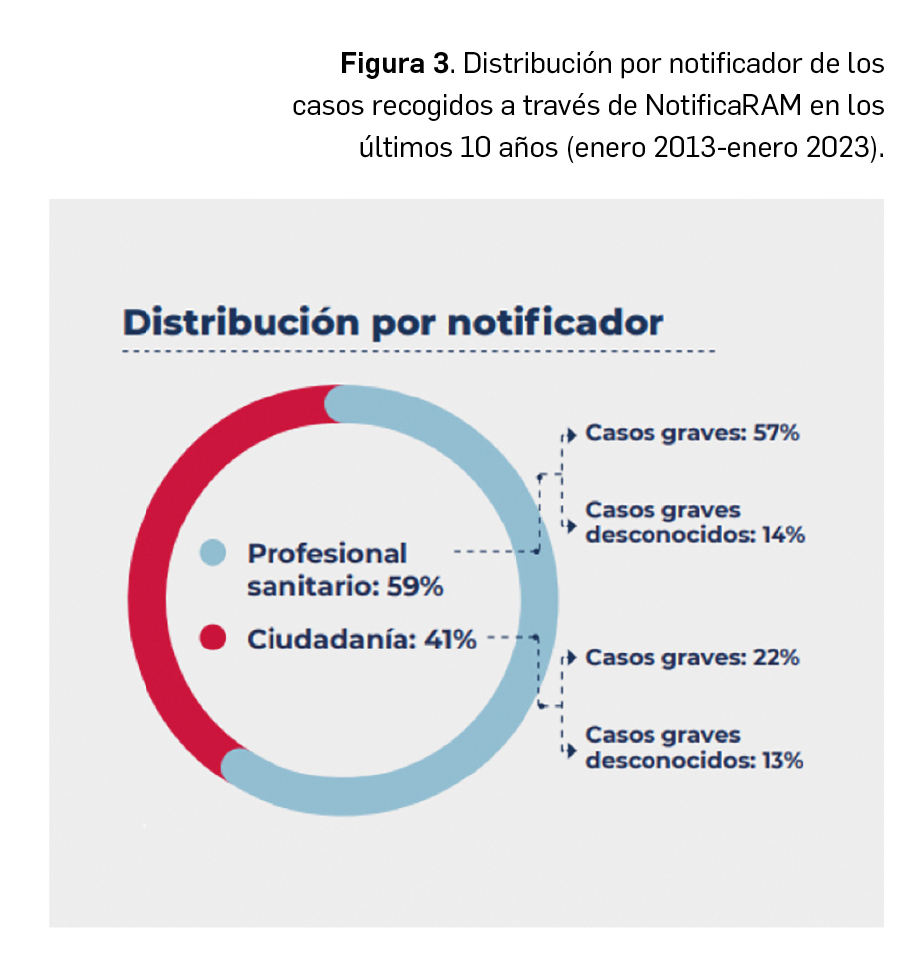
Son estos casos de RAM graves e inesperadas, recogidos a través de www.notificaRAM.es, los que han permitido al SEFV-H iniciar el estudio de nuevas señales que han sido evaluadas en la Unión Europea, en el seno del PRAC, y han dado lugar a cambios en las fichas técnicas y prospectos de los medicamentos como, por ejemplo, el sarcoma de Kaposi con los medicamentos anti-TNF, la hiponatremia con vortioxetina o el fenómeno de Raynaud con labetalol (AEMPS, 2023a).
Desde la AEMPS, se agradece a los profesionales de la salud y a la ciudadanía el esfuerzo de notificar las sospechas de reacciones adversas. Su colaboración es esencial para mejorar el conocimiento sobre los medicamentos. Se deben notificar las sospechas reacciones adversas a los medicamentos a través de: www.notificaRAM.es.
Cualquier otro medio puesto a disposición por su Centro autonómico de farmacovigilancia (AEMPS, 2023b).
Recomendaciones
Después de finalizar la pandemia de la COVID-19 causada por el coronavirus SARS-CoV2, con un resultado global de 750 millones de casos diagnosticados de COVID-19, junto con 7 millones de muertos en todo el mundo, podemos decir que el éxito de la campaña de farmacovigilancia de las más de 13 mil millones de dosis de vacunas frente a la COVID-19 nos hace seguir recomendando la utilización del Sistema Español de Farmacovigilancia Humana (SEFV-H) como una herramienta fundamental para el uso racional de los medicamentos. Y en el ámbito europeo, basado en el trabajo colaborativo de las 27 autoridades reguladoras de la Unión Europea, coordinados por la EMA: un modelo regional y cooperativo, único en el mundo. Esta ejemplaridad puede servir de modelo a nuevas iniciativas de integración reguladora, como la recientemente propuesta Agencia Reguladora de Medicamentos y Dispositivos Médicos de Latinoamérica y el Caribe (AMLAC), según la “Declaración de Acapulco”, firmada entre las agencias reguladoras de México (COFEPRIS), de Cuba (CECMED) y Colombia (INVIMA), el pasado 26 de abril de 2023 (COFEPRIS, 2023).
Para finalizar, una mención sobre la extensión de la iniciativa del formulario electrónico NotificaRAM. En estos 10 años ha servido de referencia y modelo en la AEMPS para similares necesidades: como en farmacovigilancia veterinaria para la notificación de RAM de medicamentos de uso veterinario (NotificaVET); en tecnovigilancia para la notificación de incidentes con productos sanitarios / dispositivos médicos (NotificaPS); y en cosmetovigilancia, para la notificación de efectos no deseados con productos cosméticos (NotificaCS).
Por último, hay que recordar que esta solución tecnológica ha cruzado fronteras, e incluso océanos: se ha adaptado al sistema regional centroamericano de farmacovigilancia, que utiliza la base de datos FACEDRA (Farmacovigilancia Centroamericana, Datos de Reacciones Adversas), y su app de notificación electrónica que se denomina Noti-FACEDRA.
Por todo ello, se agradece a todos los profesionales sanitarios y a los ciudadanos el esfuerzo realizado en 2021 para la notificación de las sospechas de reacciones adversas, en particular con las vacunas frente a COVID-19. Su colaboración ha sido y será esencial para mejorar el conocimiento del perfil de seguridad de los medicamentos. Por lo tanto, solo resta seguir solicitando la notificación de todas las sospechas de reacciones adversas de los medicamentos, en particular las de los de reciente autorización (triángulo▼) por los medios establecidos en el Sistema Español de Farmacovigilancia Humana (ver Información importante, al final de esta sección).
Bibliografía
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).SEFV-H. Resumen de Actividad 2022, Nº 5. Publicado el 9 de mayo de 2023. Disponible en la web de la AEMPS: https://www.aemps.gob.es/vigilancia/medicamentosUsoHumano/SEFV-H/docs/Informe_Anual_FV-2022.pdf (consultado 05 de julio de 2023).
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Directorio de Centros Autonómicos del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano (SEFV-H). 18 abril 2023. Disponible en la web de la AEMPS: https://www.aemps.gob.es/medicamentos-de-uso-humano/directorio-de-centros-autonomicos-del-sistema-espanol-de-medicamentos-de-uso-humano-sefv-h/ (consultado 05 de julio de 2023).
-
- Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS). Se firma Declaración de Acapulco para creación de la Agencia Reguladora de Medicamentos y Dispositivos Médicos de Latinoamérica y el Caribe. Comunicado conjunto, 26 abril 2023. Disponible en la web: https://www.gob.mx/cofepris/es/articulos/se-firma-declaracion-de-acapulco-para-creacion-de-la-agencia-reguladora-de-medicamentos-y-dispositivos-medicos-de-latinoamerica-y-el-caribe?idiom=es (consultado 05 de julio de 2023).
-
- Uppsala Monitoring Centre (UMC). The year in review. Annual Report, July 2021–June 2022. Disponible en la web del UMC https://who-umc.org/media/cgnlrs5v/umc-annual-report-2021-22.pdf (consultado 05 julio 2023).
Artículos relacionados
-
5 Dic 2025Riesgo de rabdomiólisis por interacción entre estatinas y los inhibidores de las CDK Actualidad
-
5 Dic 2025Nueva Zelanda: riesgo potencial de cambios de humor con los nuevos anticoagulantes orales de acción directa Actualidad
-
5 Dic 2025Burosumab (Crysvita®): riesgo de hipercalcemia grave Actualidad




