Retirada del mercado español de medicamentos que contienen ranitidina por vía oral
 Nº427
Nº427
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha anunciado la retirada del mercado de todos los medicamentos con ranitidina. La existencia de trazas de nitrosaminas cancerígenas ha motivado esta decisión hasta que finalice la revisión europea del problema.
La ranitidina es un fármaco que se utiliza para reducir la producción de ácido en el estómago en situaciones como la úlcera gástrica o el reflujo gastroesofágico.
La AEMPS ha informado1 recientemente de la decisión de retirada del mercado de los medicamentos con ranitidina. La AEMPS informó el pasado 13 de septiembre del inicio, a nivel europeo, de dos procedimientos de revisión de la presencia de nitrosaminas en medicamentos de uso humano. El primero se inicia para revisar la posible presencia de nitrosaminas en los medicamentos que contienen ranitidina. El segundo procedimiento iniciado se orienta a elaborar unas directrices que eviten la presencia de estas impurezas en todos los medicamentos de uso humano de síntesis química. Para ampliar este aspecto, se puede consultar la nota titulada “Revisión de los medicamentos que contienen ranitidina por la presencia de nitrosaminas” (Nota Informativa2 MUH, 22/2019). En el marco de esta revisión se han analizado lotes de medicamentos que contienen este principio activo, ranitidina, detectándose la presencia de trazas de N-nitrosodimetilamina (NDMA) en varios de estos lotes.
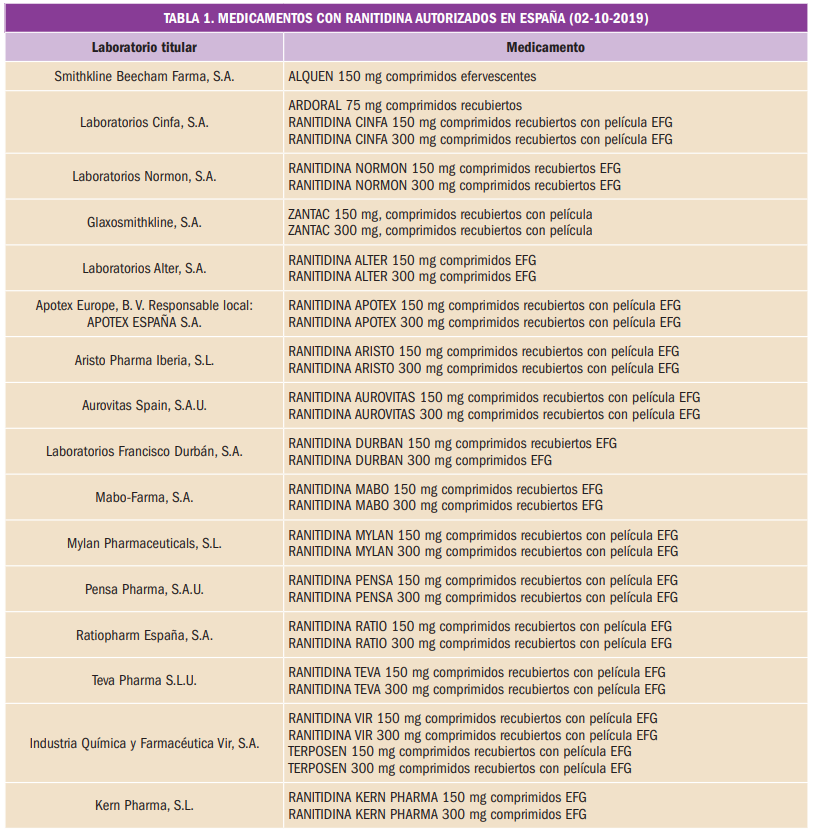
Por ello, la AEMPS, en España, ha ordenado la retirada de todos los lotes de ranitidina en comprimidos disponibles en el mercado. Los medicamentos, correspondientes a 16 laboratorios titulares de autorización de comercialización, se relacionan en la Tabla 1.
La AEMPS ha adoptado esta retirada, que se está realizando también a nivel europeo e internacional, como medida de precaución y con el fin de reducir al mínimo la exposición a esta sustancia. Dentro de este criterio de precaución, los medicamentos con ranitidina intravenosa permanecen en el mercado y no son objeto de retirada, al ser esenciales en algunas indicaciones terapéuticas, tales como la prevención de hipersensibilidad y reacciones relacionas con la infusión con paclitaxel (Abraxane® y EFG) y patisiran (▼Onpattro®, aún no comercializado en España).
Como se ha informado previamente, la NDMA está clasificada como un probable carcinógeno en humanos, en base a estudios en animales. Está presente en algunos alimentos y en algunas fuentes de agua, pero no es esperable que cause ningún daño cuando se ingiere en cantidades muy pequeñas.
Con la información disponible, no hay evidencia de que la presencia de esta sustancia haya podido producir daño alguno a los pacientes que han consumido el medicamento. Sin embargo, el potencial riesgo derivado del efecto acumulativo de la citada impureza hace necesaria la adopción de medidas de precaución para evitar su presencia en medicamentos.
Recomendaciones
No está justificado en ningún caso que los pacientes interrumpan los tratamientos con ranitidina sin consultar con su médico, ya que el riesgo de dejar de tomar el medicamento es considerablemente mayor que el riesgo de seguirlo tomándolo hasta la siguiente consulta con su médico.
Se informa de que existen en el mercado otros medicamentos, con otros principios activos, que tienen las mismas indicaciones terapéuticas. Por ello, los pacientes que toman medicamentos que contienen ranitidina pueden consultar a su médico para contemplar la posibilidad de cambiar a otros medicamentos. Entre ellos se encuentran los inhibidores de la bomba de protones, como el omeprazol (Arapride®, Belmazol®, Dolintol®, Gastrimut®, Losec®, Nuclosina®, Omapren®, Omeprotect®, Ompranyt®, Parizac®, Pepticum®, Ulcesep® y EFG), esomeprazol (Axiago®, Emanera®, Nexium®, Vimovo® y EFG), pantoprazol (Alapanzol®, Anagastra®, Citrel®, Nolpaza®, Normogastrol®, Pantecta®, Ulcotenal® y EFG) o lansoprazol (Dostab® Flas, Duomate®, Estomil®, Lanzol®, Monolitum®, Opiren®, Pro-Ulco® y EFG) y los antagonistas de los receptores H2, como la famotidina (Pepcid® y EFG).
La revisión de los medicamentos que contienen ranitidina sigue en curso pero, y en tanto se produjeran novedades en la revisión, se informará puntualmente de ellas.
Referencias
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Retirada del mercado de medicamentos que contienen ranitidina vía oral. Nota Informativa ICM (CONT), 14/2019, 1 de octubre de 2019. Disponible en la página web de la AEMPS: https://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/calidad/2019/docs/NI-ICM-CONT-14-2019-nitrosaminas.pdf (consultado de 2 de septiembre de 2019).
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Revisión de los medicamentos que contienen ranitidina por la presencia de nitrosaminas. Nota Informativa MUH, 22/2019, 13 de septiembre de 2019. Disponible en la web: https://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/calidad/2019/NI-MUH_22-2019-nitrosaminas.htm (consultado de 2 de septiembre de 2019).
Artículos relacionados
-
5 Dic 2025Riesgo de rabdomiólisis por interacción entre estatinas y los inhibidores de las CDK Actualidad
-
5 Dic 2025Nueva Zelanda: riesgo potencial de cambios de humor con los nuevos anticoagulantes orales de acción directa Actualidad
-
5 Dic 2025Burosumab (Crysvita®): riesgo de hipercalcemia grave Actualidad




