Retinoides (acitretina, alitretinoína, isotretinoína): actualización de las medidas para evitar la exposición durante el embarazo y de las advertencias sobre efectos neuropsiquiátricos
 Nº412
Nº412
Tras la revisión en la Unión Europea (UE) de la información disponible sobre el riesgo de malformaciones congénitas y los datos de sus programas de prevención de embarazos establecidos en los países de la UE, así como de la información sobre el riesgo de trastornos neuropsiquiátricos, el PRAC ha recomendado modificar y armonizar estos programas en la UE y actualizar la información de los trastornos neuropsiquiátricos en la ficha técnica y prospecto de los retinoides administrados por vía oral. Para los retinoides tópicos se ha concluido que no tienen asociados estos riesgos, no obstante, se recomienda no utilizarlos durante el embarazo, ni en mujeres que estén planificando un embarazo. La AEMPS recomienda a los profesionales seguir estrictamente las condiciones de uso que recogerán las fichas técnicas de estos medicamentos y extremar las precauciones para evitar la exposición a los mismos durante el embarazo.
Recientemente la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha informado1 de las recomendaciones del Comité para la Evaluación de Riesgos en Farmacovigilancia europeo (PRAC), una vez evaluada la información sobre riesgo teratogénico y neuropsiquiátrico de los retinoides, tanto por vía oral como tópico.
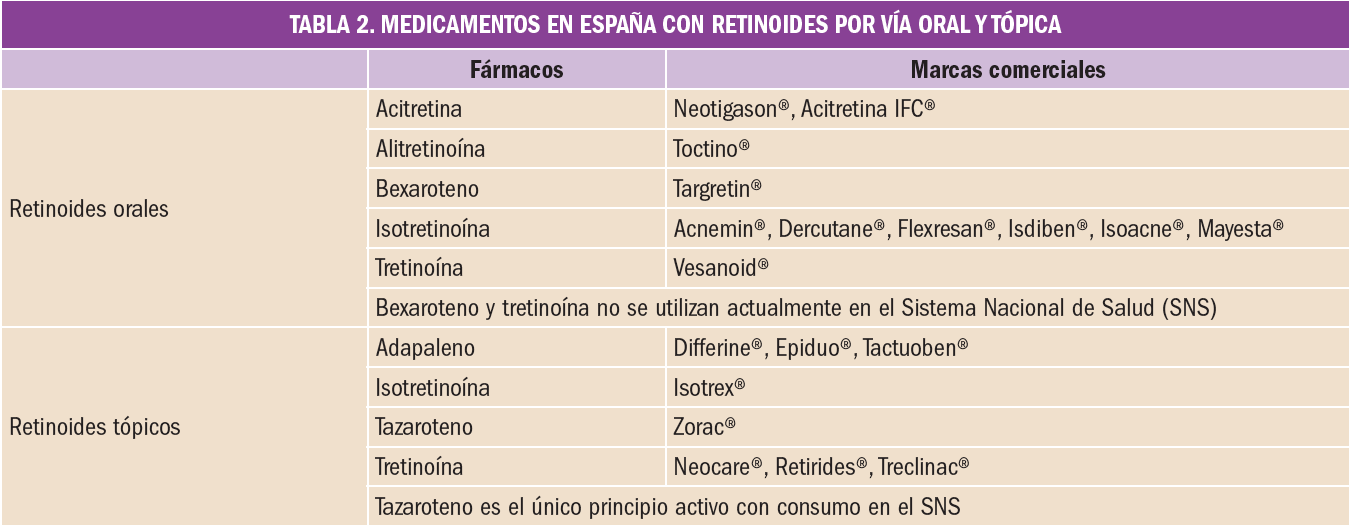
Los retinoides, derivados de la vitamina A, están indicados fundamentalmente en el tratamiento de distintas patologías de tipo dermatológico. En España se encuentran comercializados diversos medicamentos de administración oral que contienen acitretina, alitretinoína e isotretinoína y de administración tópica con tazaroteno, que se describen en la Tabla 2
Actualmente ya se describen en las fichas técnicas y prospectos de estos medicamentos tanto el riesgo de malformaciones congénitas asociado al uso de retinoides orales, como el de efectos neuropsiquiátricos (p. ej. depresión, ansiedad, cambios de humor o de comportamiento). No obstante, el Comité europeo para la Evaluación de Riesgos en Farmacovigilancia (PRAC) ha finalizado recientemente una revisión de la información actualmente disponible sobre estos riesgos.
El motivo de esta revisión ha sido la necesidad de evaluar: las posibles mejoras en las medidas de minimización de riesgos relacionadas con la teratogenicidad de los retinoides orales y su armonización en los países de la UE, si el riesgo de malformaciones congénitas se asocia también al uso de retinoides administrados por vía tópica, así como la información actual disponible sobre los efectos neuropsiquiátricos que pueden asociarse al uso de retinoides.
Las conclusiones y recomendaciones del PRAC han sido las siguientes:
- En relación al riesgo de malformaciones congénitas:
- Los retinoides orales no se deben utilizar durante el embarazo. Tampoco se deben utilizar en mujeres con capacidad de gestación excepto que se cumplan todas las condiciones del Plan de Prevención de Embarazos (PPE) para estos medicamentos (en España, acitretina, alitretinoína e isotretinoína).
- El PPE para estos medicamentos incluye el asesoramiento de las mujeres en cuanto a los riesgos de su uso durante el embarazo, requerimiento del uso de métodos anticonceptivos durante todo el tratamiento (se recomienda al menos un método no dependiente de administración por la usuaria) y posteriormente según las características de cada fármaco, así como la comprobación periódica (idealmente de forma mensual) de la ausencia de embarazo durante el tratamiento en las mujeres con capacidad de gestación. Por último, la firma por las pacientes y el médico de un documento sobre reconocimiento del riesgo.
- El PRAC ha recomendado, para facilitar esta labor a los profesionales sanitarios, elaborar materiales de prevención de riesgos, simplificando los actualmente existentes y aplicables en todos los países de la UE. Estos materiales consistirán en lista/documento de comprobación para profesionales sanitarios, tarjeta de información para las pacientes y documento anual de reconocimiento del riesgo. Adicionalmente se incluirá una advertencia en el exterior de los envases de estos medicamentos.
- Para bexaroteno y tretinoína, ambos de administración oral, no se considera necesario establecer un PPE específico dado que tienen indicaciones diferentes (trastornos linfoproliferativos) y se utilizan en grupos de pacientes diferentes, fundamentalmente en el ámbito hospitalario.
- Para retinoides aplicados por vía tópica, se ha concluido que su absorción sistémica es prácticamente nula y no se considera que esta forma de administración se asocie con riesgo teratogénico. No obstante, su aplicación excesiva podría aumentar dicha absorción, por lo que, como medida de precaución, el PRAC ha recomendado que no se deben utilizar en el embarazo ni en mujeres que estén planificando un embarazo.
- Respecto al riesgo de trastornos neuropsiquiátricos:
- Los datos procedentes de algunos estudios presentan limitaciones y no permiten establecer una relación clara con el uso de retinoides orales. No obstante, en base a los casos notificados y considerando que los pacientes con patología dermatológica severa pueden ser más vulnerables a la aparición de alteraciones neuropsiquiátricas, se recomienda a los profesionales y pacientes, y/o sus cuidadores, que estén atentos a la aparición de signos y síntomas de alteraciones neuropsiquiátricas durante el tratamiento (p. ej. cambios de humor o de comportamiento).
El PRAC ha recomendado actualizar esta información en las fichas técnicas y prospectos de los retinoides orales y ha considerado que los retinoides de administración tópica no se asocian con estos efectos.
Estas recomendaciones deberán ser ratificadas por el Comité de Evaluación de Medicamentos (CHMP) de la Agencia Europea de Medicamentos (EMA) y, eventualmente, por la Comisión Europea, que concluirán con una decisión final y vinculante para toda la UE.
Recomendaciones
Teniendo en cuenta estas conclusiones, la AEMPS recomienda a los profesionales sanitarios:
- Extremar las precauciones para evitar la exposición de retinoides durante el embarazo, cumpliendo estrictamente las condiciones de uso autorizadas, establecidas en las fichas técnicas de estos medicamentos. En particular:
- Establecer el tratamiento con retinoides orales solo en el caso de que se considere absolutamente necesario.
- Informar detalladamente a las mujeres con capacidad de gestación y/o a sus cuidadores sobre el riesgo de malformaciones congénitas y aborto espontáneo asociado a estos medicamentos, así como las medidas preventivas que se deben adoptar durante el tratamiento y posteriormente.
- Asegurar el uso de métodos anticonceptivos por las pacientes con capacidad de gestación, tanto desde el inicio del tratamiento como a lo largo del mismo y durante un periodo tras su finalización que depende del medicamento utilizado (hasta un mes después para alitretinoína e isotretinoína y tres años para acitretina).
- Para comprobar la ausencia de embarazo antes, durante y posteriormente al tratamiento se deben realizar controles periódicos (idealmente mensualmente durante el tratamiento y un mes después de finalizarlo, en el caso de acitretina se recomienda cada 1 a 3 meses durante los tres años posteriores).
- Vigilar la posible aparición en los pacientes en tratamiento de síntomas o signos de alteraciones neuropsiquiátricas como cambios de humor o de comportamiento, en particular en pacientes con antecedentes de depresión. Informar a los pacientes y a sus familiares o cuidadores sobre la posible aparición de estas alteraciones y que acudan al médico en el caso de estos síntomas apareciesen.
Información adicional
Las condiciones y detalles del PPE para retinoides orales se actualizarán en las fichas técnicas y prospectos de estos medicamentos. Simultáneamente se actualizarán los materiales informativos sobre prevención de riesgos para profesionales y pacientes actualmente disponibles en España (para alitretinoína e isotretinoína), que se podrán consultar en la página web de la AEMPS (sección CIMA y apartado correspondiente de la sección de Farmacovigilancia). También se elaborarán este tipo de materiales para acitretina.
Referencias
- Agencia Española de Medicamentos y Productos Sanitarios. Retinoides (acitretina, alitretinoína, isotretinoína): actualización de las medidas para evitar la exposición durante el embarazo y de las advertencias sobre efectos neuropsiquiátricos. Nota informativa MUH (FV), 6/2018, de 5 marzo de 2018 (correcciones 19 marzo). Disponible en la página web: https://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2018/NI-MUH_FV_02-Esmya.htm (consultado 2 abril 2018).
Artículos relacionados
-
5 Dic 2025Riesgo de rabdomiólisis por interacción entre estatinas y los inhibidores de las CDK Actualidad
-
5 Dic 2025Nueva Zelanda: riesgo potencial de cambios de humor con los nuevos anticoagulantes orales de acción directa Actualidad
-
5 Dic 2025Burosumab (Crysvita®): riesgo de hipercalcemia grave Actualidad




