Nuevas recomendaciones sobre la prevención de embarazos con el uso de micofenolato
 Nº411
Nº411
Los laboratorios farmacéuticos titulares de la autorización de comercialización de los medicamentos que contienen micofenolato, profármaco del ácido micofenólico, de acuerdo con la Agencia Europea de Medicamentos (EMA) y con la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), han informado sobre una nueva actualización de seguridad en relación con su riesgo teratogénico.
Recientemente la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), en coordinación con la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés) ha obligado a los laboratorios titulares de la comercialización de los medicamentos que contienen micofenolato a comunicar1 la siguiente información directamente a los profesionales sanitarios mediante cartas personalizadas, denominadas Direct Healthcare Professional Communications o DHPC, en la normativa europea.
El micofenolato, se utiliza para prevenir el rechazo de trasplantes. Es un potente agente teratógeno en humanos del que se conoce que produce un aumento del riesgo de abortos espontáneos y malformaciones congénitas en caso de exposición durante el embarazo. Se ha estimado la frecuencia de abortos espontáneos en un rango de un 45% al 49% en mujeres embarazadas expuestas a micofenolato. Las malformaciones congénitas se sitúan entre el 23% y el 27% de los nacidos vivos de mujeres expuestas durante el embarazo.
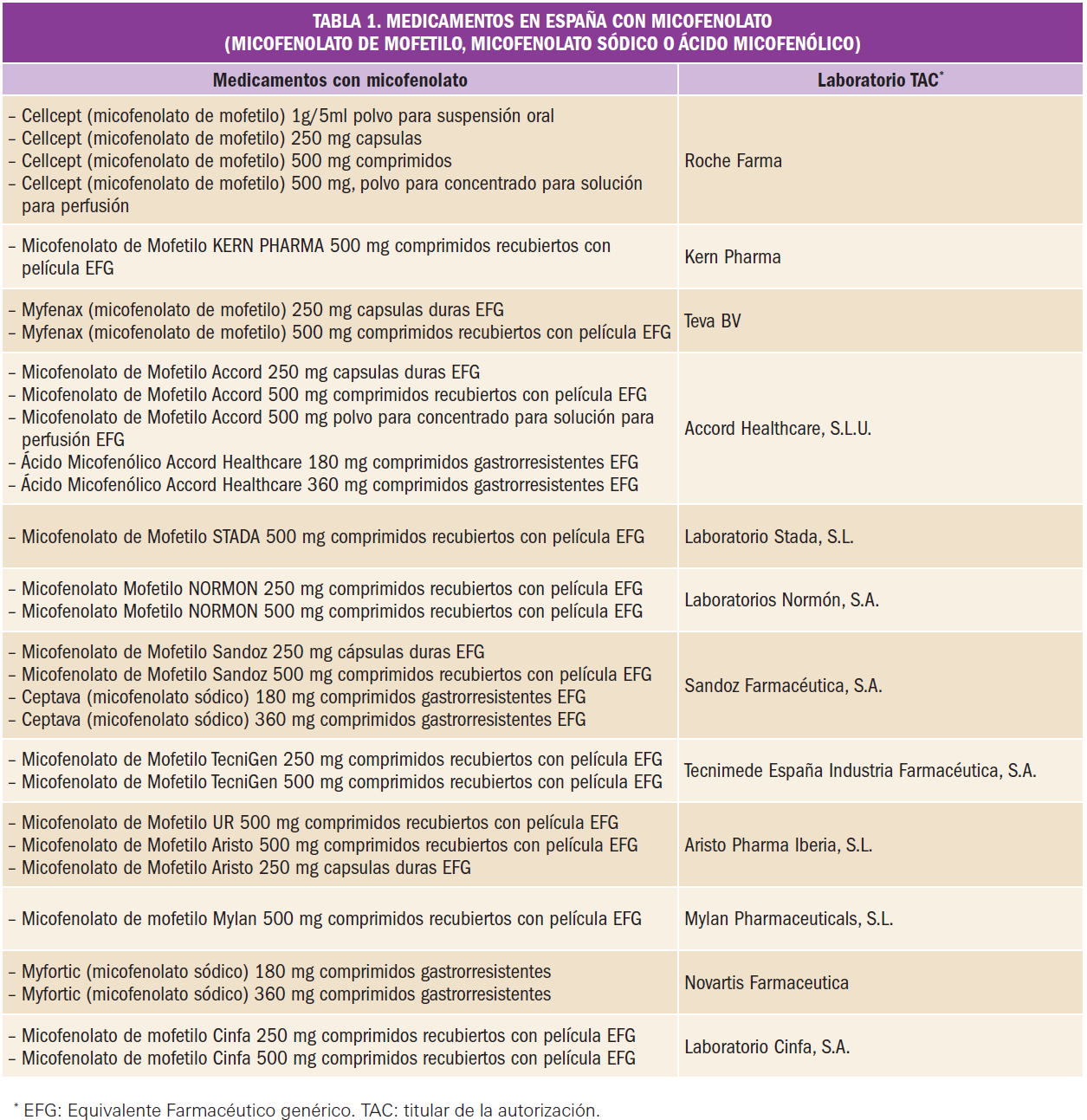
Por este motivo, los medicamentos con micofenolato (ver Tabla 1), bien sea micofenolato de mofetilo (MMF), micofenolato sódico o ácido micofenólico (MPA), están contraindicados en mujeres con capacidad de gestación que no usen métodos anticonceptivos eficaces. Asimismo están contraindicados en mujeres embarazadas, a menos que no se disponga de alternativa terapéutica adecuada para evitar el rechazo del trasplante. Se recuerda, que dado lo anteriormente expuesto, antes de comenzar el tratamiento se requieren pruebas de embarazo negativas (para una información más detallada al respecto se debe consultar sus fichas técnicas).
En base a los resultados obtenidos tras una reciente y exhaustiva revisión, llevada a cabo sobre los datos clínicos y no clínicos disponibles de pacientes varones con potencial capacidad para engendrar hijos mientras recibían tratamiento con MMF o MPA, la EMA ha actualizado las recomendaciones establecidas en el 2015 en relación con estos medicamentos con el fin de prevenir embarazos.
Aunque no se ha determinado la cantidad de micofenolato presente en el semen de pacientes varones tratados con micofenolato, los cálculos basados en datos procedentes de animales muestran que la cantidad máxima de micofenolato que potencialmente podría ser transferida a la mujer es baja por lo que es poco probable que este tuviese algún efecto teratógeno. Sin embargo, en estudios realizados en animales se ha demostrado que el micofenolato es genotóxico a concentraciones que exceden solo en pequeños márgenes las exposiciones terapéuticas en humanos, de modo que no puede ser excluido completamente el riesgo de efectos genotóxicos en los espermatozoides.
Recomendaciones
Según la evidencia clínica disponible hasta el momento no indica que exista un mayor riesgo de malformaciones congénitas o de abortos espontáneos en aquellos embarazos en los que sea el padre quien se encuentre en tratamiento con micofenolato. Sin embargo, y dado que tanto el micofenolato de mofetilo como el micofenolato sódico y el ácido micofenólico son genotóxicos en humanos, este riesgo no puede excluirse por completo.
- Por estas razones, en el caso de los pacientes varones se recomienda, que bien ellos o bien sus parejas del sexo femenino, utilicen métodos anticonceptivos eficaces, durante el tratamiento y durante los 90 días siguientes a la interrupción del mismo.
- Se mantienen el riesgo y las recomendaciones en mujeres, por lo que el micofenolato no debe administrarse en mujeres con capacidad de gestación que no estén utilizando un método anticonceptivo eficaz. La administración de estos medicamentos también se encuentra contraindicada en mujeres embarazadas a menos que no se disponga de una alternativa terapéutica adecuada para prevenir el rechazo del trasplante.
- En el caso de las mujeres con capacidad de gestación tratadas con micofenolato deberán utilizar, antes de comenzar el tratamiento, a lo largo del mismo, y durante seis semanas después de finalizarlo, al menos, un método eficaz de anticoncepción (para mayor seguridad resulta aconsejable la utilización de dos).
Referencias
- Agencia Española de Medicamentos y Productos Sanitarios. Micofenolato: nuevas recomendaciones sobre la prevención de embarazos. Comunicación dirigida a profesionales sanitarios. 22 enero 2018. Disponible en la página web de la AEMPS: https://sinaem.agemed.es/CartasFarmacovigilanciaDoc/2018/Cellcept-I-PSUSA-DHPC-ES-propuesta-final-2.pdf (consultado 26 febrero 2018).
Artículos relacionados
-
5 Dic 2025Riesgo de rabdomiólisis por interacción entre estatinas y los inhibidores de las CDK Actualidad
-
5 Dic 2025Nueva Zelanda: riesgo potencial de cambios de humor con los nuevos anticoagulantes orales de acción directa Actualidad
-
5 Dic 2025Burosumab (Crysvita®): riesgo de hipercalcemia grave Actualidad




