Información de seguridad procedente de la evaluación periódica de datos de farmacovigilancia que decide el PRAC
 Nº463
Nº463
El PRAC es el Comité europeo para la Evaluación de Riesgos en Farmacovigilancia. En sus reuniones mensuales se deciden cambios en la información autorizada de las fichas técnicas y de los prospectos de los medicamentos europeos por motivos de seguridad.
Una vez que se revisan y evalúan los datos de los informes periódicos de seguridad (IPS; en inglés PSUR), de forma colaborativa entre todas las 27 agencias nacionales, el Estado miembro principal que realiza la evaluación única de los IPS, o PSUSA (Periodic Safety Update report Single Assessments), propone los cambios y se aprueban en las reuniones mensuales del PRAC. Cuando afectan a medicamentos de registros nacionales se validan por el CMDh (Coordination Group for Mutual Recognition and Decentralised Procedures – Human), de la red de Jefes de todas las Agencias de Medicamentos (HMA, Heads of Medicines Agencies) en sus reuniones mensuales, durante 3 días. Un procedimiento único, complejo y colaborativo de las 27 agencias nacionales de medicamentos de la Unión Europea. En la tabla siguiente se muestran los últimos cambios de información de seguridad acordados recientemente en el PRAC.
El Comité europeo para la Evaluación de Riesgos en Farmacovigilancia (PRAC) ha acordado cambios en las fichas técnicas y los prospectos de los siguientes medicamentos, siendo los más importantes los que se describen en la Tabla 1, según informa la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) en sus Boletines mensuales de Seguridad de Medicamentos de Uso humano del mes de noviembre y de diciembre de 2022 (AEMPS, 2022a; AEMPS, 2022b).
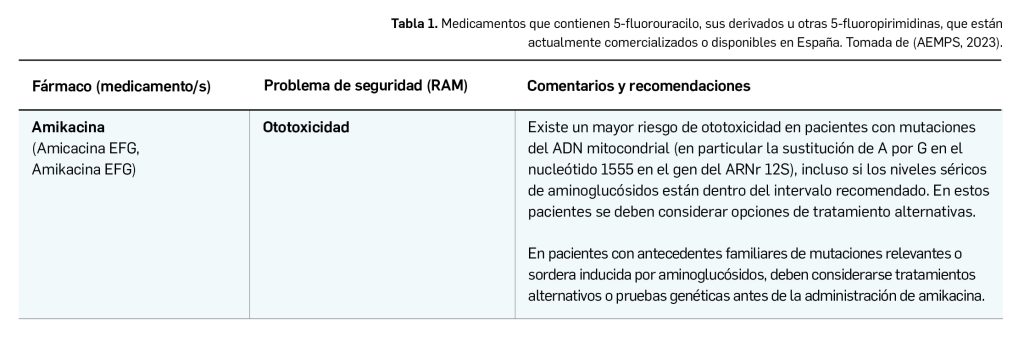
Continúa la tabla aquí
Las fichas técnicas y prospectos de los medicamentos pueden consultarse en la web de la AEMPS, dentro de la sección CIMA: Centro de Información Online de Medicamentos.
Esta información que se incorpora a las fichas técnicas y prospectos de los medicamentos supone una actualización permanente, por lo que es necesario consultar sus datos y la fecha de la actualización (que figura al final del texto de las fichas técnicas y prospectos), cuando se consultan en la web de la AEMPS (sección CIMA: Centro de Información Online de Medicamentos).
Bibliografía
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Nueva información de seguridad procedente de la evaluación periódica de los datos de farmacovigilancia. Boletín mensual de seguridad de la AEMPS sobre medicamentos de uso humano del mes de enero de 2023. Publicado el 22 de marzo de 2023. Disponible en la web de la AEMPS: https://www.aemps.gob.es/informa/boletin-mensual-de-seguridad-de-la-aemps-sobre-medicamentos-de-uso-humano-del-mes-de-enero-de-2023 (consultado a 8 de mayo de 2023).
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Nueva información de seguridad procedente de la evaluación periódica de los datos de farmacovigilancia. Boletín mensual de seguridad de la AEMPS sobre medicamentos de uso humano del mes de febrero de 2023. Actualizado el 25 de abril de 2023. Disponible en la web de la AEMPS: https://www.aemps.gob.es/informa/boletin-mensual-de-seguridad-de-la-aemps-sobre-medicamentos-de-uso-humano-del-mes-de-febrero-de-2023/ (consultado a 8 de mayo de 2023)
Artículos relacionados
-
5 Dic 2025Riesgo de rabdomiólisis por interacción entre estatinas y los inhibidores de las CDK Actualidad
-
5 Dic 2025Nueva Zelanda: riesgo potencial de cambios de humor con los nuevos anticoagulantes orales de acción directa Actualidad
-
5 Dic 2025Burosumab (Crysvita®): riesgo de hipercalcemia grave Actualidad




