Brivudina: recordatorio de interacción potencialmente mortal con antineoplásicos que contienen 5-fluoropirimidinas y con flucitosina
 Nº462
Nº462
La AEMPS ha informado recientemente sobre el riesgo grave de interacciones farmacológicas que se siguen produciendo, aún a pesar de las medidas aplicadas, y algunas con resultado mortal, al simultanear la administración de brivudina (Nervinex® y Brivudina Aristo®) con antineoplásicos del grupo de la 5-fluoropirimidinas, tales como capecitabina, 5-fluorouracilo, tegafur, floxuridina, flucitosina. Por lo tanto, nunca deben administrarse simultáneamente, sino que debe respetarse un periodo de espera como mínimo de 4 semanas entre la finalización del tratamiento con brivudina y el inicio de la administración de fluoropirimidinas.
Resulta indispensable que, antes de prescribir brivudina, el profesional médico se asegure de que el paciente no está recibiendo quimioterapia antineoplásica que contenga 5-fluoropirimidinas o flucitosina. De cara a su dispensación, el farmacéutico deberá informar al paciente y recordarle que lea detenidamente la advertencia y la tarjeta de información incluida en el envase, además del prospecto.
La AEMPS ha publicado recientemente (AEMPS, 2023) una nota recordatorio, pues a pesar de la estrategia informativa realizada previamente acerca de la contraindicación de consecuencias potencialmente mortales para el paciente (ver notas informativas MUH (FV), 7/2012 y MUH (FV), 09/2017), el Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H) sigue recibiendo notificaciones de casos debidos a la administración conjunta de brivudina y antineoplásicos que contienen 5-fluoropirimidinas. En concreto, desde la emisión de la última nota informativa, se han notificado 6 nuevos casos de esta interacción, todos graves y 4 de ellos con desenlace mortal.
El antiviral brivudina es un análogo de nucleósidos inhibidor de la replicación del virus varicela-zóster, indicado en el tratamiento precoz del herpes zóster agudo en adultos inmunocompetentes. Actualmente en España están autorizados dos medicamentos que contienen este principio activo: Nervinex® y Brivudina Aristo®.
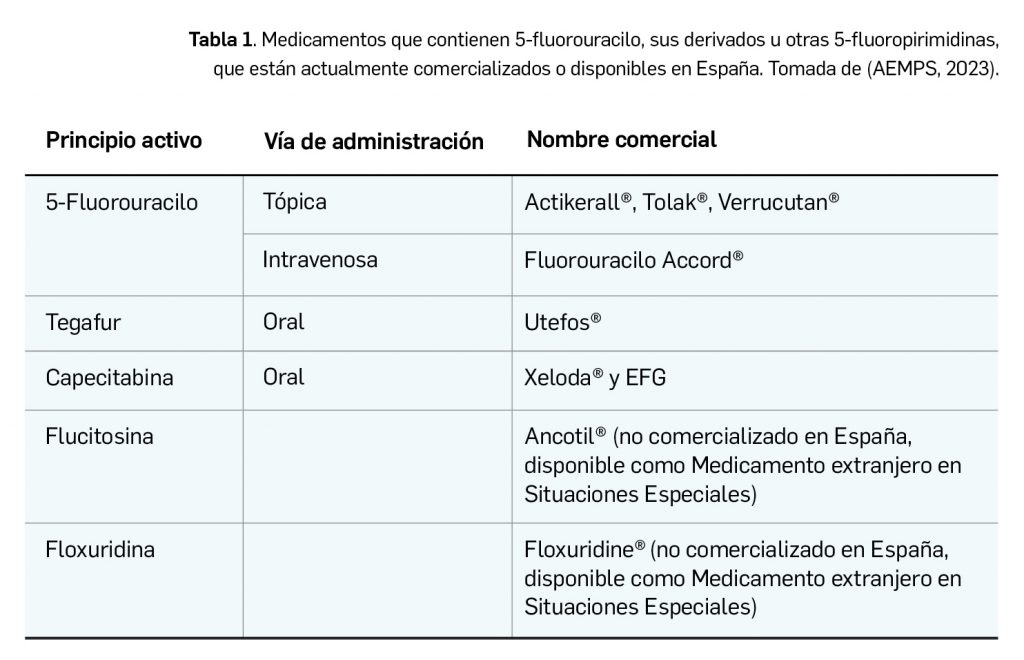
A través de su principal metabolito bromovinil-uracilo, la brivudina ejerce una inhibición irreversible de la dihidropirimidina-deshidrogenasa, una enzima que regula el metabolismo tanto de los nucleósidos naturales (por ejemplo, timidina) como de medicamentos tipo pirimidina (fluoropirimidinas) tales como capecitabina o 5-fluorouracilo (5-FU). Como consecuencia de la inhibición enzimática, se produce una sobreexposición y un aumento de la toxicidad de las fluoropirimidinas potencialmente mortal. En la Tabla 1 se muestran los medicamentos que contienen 5-FU y derivados actualmente disponibles en España.
Por tanto, la administración concomitante de brivudina y fluoropirimidinas está contraindicada y éstas no pueden administrarse durante el tratamiento con brivudina, ni en las 4 semanas posteriores a la finalización del mismo.
Existe a disposición de los profesionales sanitarios un documento informativo que incluye una lista de comprobación para el médico prescriptor con el fin de ayudarle a asegurar la idoneidad del paciente para recibir el tratamiento con brivudina y una tarjeta de información para el paciente, incluida en el envase del medicamento (Madurga, 2021).
La interacción entre brivudina y 5-fluoropirimidinas aparece ampliamente descrita en la ficha técnica y el prospecto de los medicamentos que contienen dicho principio activo, además de incluirse una advertencia en el envase del medicamento. Para una mayor información puede acceder a la ficha técnica, el prospecto y los materiales informativos disponibles en el Centro de Información Online de Medicamentos de la AEMPS (CIMA).
Recomendaciones
Teniendo en cuenta los datos expuestos anteriormente, la AEMPS considera necesario recordar muy intensamente lo expuesto a continuación.
Información para profesionales sanitarios:
- Es indispensable que, antes de prescribir, el médico se asegure de que el paciente no está recibiendo quimioterapia antineoplásica ni ninguna preparación tópica que contenga 5-fluoropirimidinas (ver Tabla 1).
- No se debe administrar brivudina (Nervinex® y Brivudina Aristo®) a pacientes que recientemente han recibido o estén recibiendo quimioterapia antineoplásica con medicamentos que contienen 5-fluorouracilo (5-FU), incluyendo también sus preparaciones tópicas, sus profármacos (por ejemplo, capecitabina, tegafur), combinación de fármacos que contengan estos principios activos u otras fluoropirimidinas o tratamiento antifúngico con flucitosina.
- No se debe comenzar tratamiento con los medicamentos citados en el punto anterior en pacientes que hayan finalizado el tratamiento con brivudina en el último mes: es necesario esperar al menos 4 semanas desde la finalización del tratamiento con brivudina.
- En caso de administración accidental de brivudina a pacientes que recientemente han recibido o están recibiendo fluoropirimidinas, es preciso suspender la administración de ambos fármacos y tomar las medidas adecuadas para reducir la toxicidad de las fluoropirimidinas. Se recomienda hospitalización inmediata y medidas para prevenir infecciones sistémicas y la deshidratación. Los síntomas de toxicidad por fármacos fluoropirimidínicos se manifiestan con náuseas, vómitos, diarrea y, en casos graves, estomatitis, mucositis, necrólisis epidérmica tóxica, neutropenia y depresión de la médula ósea.
- En el momento de la dispensación de brivudina en las farmacias comunitarias, es necesario informar y recordar al paciente que lea: a) las advertencias del envase; b) la tarjeta de información incluida en el mismo; y c) el prospecto del medicamento.
Información para pacientes:
- Antes de comenzar a tomar Nervinex® o Brivudina Aristo®, medicamentos para el tratamiento del herpes zóster, lea la tarjeta de información para el paciente que viene incluida en el envase y el prospecto del medicamento para prevenir reacciones adversas que pueden ser graves. Consulte cualquier duda con el profesional médico o farmacéutico.
- Si está recibiendo algún medicamento para el tratamiento del cáncer o el medicamento Ancotil® para una infección por hongos, no tome los medicamentos Nervinex® ni Brivudina Aristo® durante todo el tiempo de tratamiento.
- Si ha tomado Nervinex® o Brivudina Aristo® debe esperar un mínimo de 4 semanas antes de recibir un tratamiento para el cáncer con cualquier medicamento citado en la Tabla 1. Si por error ha tomado brivudina y alguno de esos medicamentos, debe interrumpir la toma de ambos medicamentos y acudir a un hospital para recibir tratamiento inmediato.
Bibliografía
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Brivudina (Nervinex y Brivudina Aristo): recordatorio de interacción potencialmente mortal con antineoplásicos que contienen 5-fluoropirimidinas (capecitabina, 5-fluorouracilo, tegafur, floxuridina) y con fluocitosina. Referencia: MUH(FV), 03/2023. Disponible en: https://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2023/NI_MUH_FV-3-2023-Brivudina.pdf (consultado a 29 de marzo de 2023).
-
- Madurga Sanz M. Toxicidad potencialmente mortal por el uso de fluoropirimidinas si se administran poco antes, simultáneamente o en las 4 semanas posteriores a la finalización del tratamiento con brivudina. Panorama Actual Med. 2021; 45 (444): 672-3. Disponible en: https://www.farmaceuticos.com/wp-content/uploads/pam/articulo/pdf/2021/06/PAM444-5-5-Farmacovigilancia-Toxicidad-mortal-uso-fluoropirimidinas-1.pdf (consultado el 29 de marzo de 2023).
Artículos relacionados
-
5 Dic 2025Riesgo de rabdomiólisis por interacción entre estatinas y los inhibidores de las CDK Actualidad
-
5 Dic 2025Nueva Zelanda: riesgo potencial de cambios de humor con los nuevos anticoagulantes orales de acción directa Actualidad
-
5 Dic 2025Burosumab (Crysvita®): riesgo de hipercalcemia grave Actualidad




