Agentes de contraste con gadolinio: recomendaciones y medidas adoptadas tras la revisión europea llevada a cabo sobre el riesgo de formación de depósitos tisulares (cerebro y otros)
 Nº410
Nº410
Una revisión llevada a cabo por la Agencia Europea de Medicamentos (EMA) ha confirmado que, tras la administración de agentes de contraste con gadolinio, pequeñas cantidades de este metal quedan retenidas en el tejido cerebral de los pacientes. Se ha observado una mayor retención de gadolinio en el tejido cerebral con los agentes de contraste lineales que con los macrocíclicos. Hasta el momento, no hay evidencias de que la retención de gadolinio en el cerebro procedente de cualquier agente de contraste haya causado daños en pacientes. Dado que se desconocen los efectos a largo plazo de la retención de gadolinio en el tejido cerebral, la EMA ha recomendado la suspensión en la Unión Europea (UE) de los agentes lineales intravenosos, con la excepción del ácido gadoxético y del ácido gadobénico, que permanecerán disponibles únicamente para estudios hepáticos.
Recientemente la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), igual que el resto de agencias nacionales europeas, ha obligado a los laboratorios titulares de la comercialización de contrastes de gadolinio a comunicar1 la siguiente información directamente a los profesionales sanitarios mediante cartas personalizadas, denominados Direct Healthcare Professional Communications (DHPC) en el ámbito europeo.
Previamente se llevó a cabo una revisión exhaustiva por parte de la EMA, en la que se puso de manifiesto, que tras la administración de agentes de contraste intravenosos con gadolinio durante la realización de exploraciones por resonancia magnética (RM), se producen depósitos de este metal en el tejido cerebral de los pacientes expuestos.
Se ha confirmado la formación de estos depósitos, tanto a través de estudios que miden las concentraciones de gadolinio con espectrometría de masas, como por la observación de incrementos de la intensidad de la señal en el tejido cerebral durante la realización de pruebas de RM. Se ha observado una mayor retención de este metal en el tejido cerebral con los agentes lineales que con los de tipo macrocíclico.
En el momento actual no hay evidencia de que la acumulación de ninguno de estos agentes haya causado daños en pacientes, y no se han atribuido efectos neurológicos adversos, tales como trastornos cognitivos o de movimiento, a ningún producto. Sin embargo, los riesgos a largo plazo de estos depósitos cerebrales son desconocidos y los datos de seguridad a largo plazo son limitados.
Recomendaciones
Teniendo en cuenta toda la información disponible, entre la que se incluyen los datos que se conocen acerca de la retención de gadolinio en otros tejidos, así como las opiniones de los grupos de expertos consultados, la EMA ha adoptado las siguientes medidas y recomendaciones al objeto de prevenir cualquier riesgo que pudiera asociarse a la acumulación de gadolinio en el cerebro:
- Se suspenden las autorizaciones de comercialización de los agentes intravenosos lineales gadodiamida y gadoversetamida y de la formulación intravenosa del ácido gadopentético.
- Se considera que el balance beneficio-riesgo de los agentes intravenosos lineales ácido gadoxético y ácido gadobénico es favorable únicamente para estudios hepáticos. Ambos agentes son captados por el hígado y pueden utilizarse para la obtención de imágenes de lesiones hepáticas mal vascularizadas, especialmente en imágenes de fase tardía, en las que los agentes macrocíclicos no son adecuados. Por lo tanto, se mantiene la autorización de comercialización del ácido gadoxético para su utilización en exploraciones hepáticas y se restringe la del ácido gadobénico, que sólo podrá usarse para dicho tipo de exploraciones.
- Se mantiene la autorización de comercialización de la formulación intra-articular de ácido gadopentético (no disponible en España), dado que la dosis del gadolinio utilizada para la administración de inyecciones articulares es baja y lo más probable es que los pacientes no requieran inyecciones repetidas.
- Todos los agentes macrocíclicos examinados – gadobutrol, ácido gadotérico y gadoteridol – permanecerán autorizados para sus indicaciones actuales.
- Dado que todos los agentes de contraste con gadolinio pueden causar la retención de este metal, se aconseja a los profesionales sanitarios que utilicen dichos productos sólo cuando no se pueda obtener información de diagnóstico esencial con exploraciones sin contraste. Asimismo deberán utilizar las dosis más bajas que proporcionen un realce suficiente para el diagnóstico.
- Se han actualizado las fichas técnicas y prospectos de todos los agentes de contraste con gadolinio para incluir la información sobre seguridad que acaba de referirse y que se resumen en la siguiente tabla.
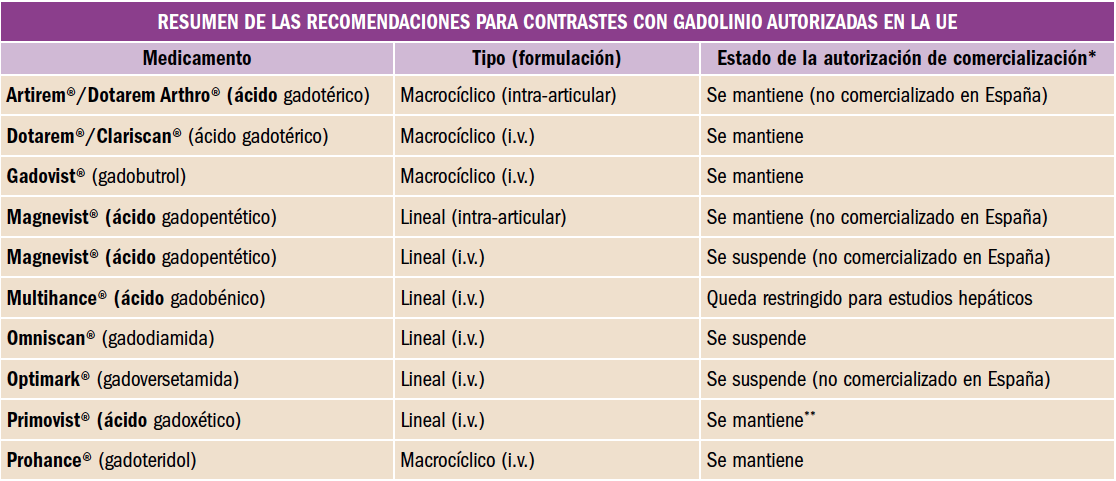
* Se actualizará la información de prescripción para productos cuya autorización se mantiene.
** Ácido gadoxético está autorizado únicamente para estudios hepáticos (órgano específico).
Referencias
- Agencia Española de Medicamentos y Productos Sanitarios. Agentes de contraste con gadolinio: recomendaciones y medidas adoptadas tras la revisión europea llevada a cabo sobre el riesgo de formación de depósitos tisulares (cerebro y otros). Comunicación dirigida a profesionales sanitarios. Diciembre 2017. Disponible en: https://sinaem.agemed.es/CartasFarmacovigilanciaDoc/2017/2017-12-12-Gadolinio.pdf (consultado 1 febrero 2018).
Artículos relacionados
-
5 Dic 2025Riesgo de rabdomiólisis por interacción entre estatinas y los inhibidores de las CDK Actualidad
-
5 Dic 2025Nueva Zelanda: riesgo potencial de cambios de humor con los nuevos anticoagulantes orales de acción directa Actualidad
-
5 Dic 2025Burosumab (Crysvita®): riesgo de hipercalcemia grave Actualidad




